Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Hỗn hợp A gồm FeS (x mol), Fe dư (y mol) và S dư (0,8 gam)
FeS + 2HCl -------> FeCl2 + H2S
x………………..………x…….x (mol)
Fe + 2HCl -------> FeCl2 + H2
y…………………..…y……..y (mol)
=> Khí D gồm H2S và H2
\(M_D=\dfrac{34x+2y}{x+y}=9.2=18\) (*)
Khí D sục rất từ từ qua dung dịch CuCl2
H2S + CuCl2 -------> CuS + 2HCl
x………………………...x (mol)
=>\(n_{CuS}=x=\dfrac{9,6}{96}=0,1\left(mol\right)\)
Từ (*) => y = 0,1 (mol)
nFe = x+ y = 0,1 + 0,1= 0,2 (mol)
=> m = 0,2 .56 = 11,2 (g)
nS pư = x = 0,1 (mol)
=> p = 0,1.32 + 0,8 = 4 (g)
b) Dung dịch C chứa FeCl2
nFeCl2 = x + y = 0,2 (mol)
FeCl2 + 2NaOH -------> Fe(OH)2 + 2NaCl
0,2................................,.0,2 (mol)
4Fe(OH)2 + O2 + 2H2O -------> 4Fe(OH)3
0,2..............................................0,2 (mol)
2Fe(OH)3 ------> Fe2O3 + 3H2O
0,2........................0,1 (mol)
Chất rắn là Fe2O3
Theo PT => nFe2O3 = 0,1 mol
=> mFe2O3 = 0,1.160 = 16 gam

Ta có pthh:
\(Fe+S\underrightarrow{t^o}FeS\left(1\right)\)
x1 x1 x1 (mol)
Sau khi nung trong hỗn hợp A có :
\(\left(x-x_1\right)molS\)
\(\left(2x-x_1\right)molFe\)
và x1 mol FeS
- hòa tan A trong axit HCl dư :
\(Fe+2HCl\rightarrow FeCL_2+H_2\uparrow\left(2\right)\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\left(3\right)\)
Còn lại 0,4 g chất rắn B là lưu huỳnh dư
\(nS=x-x_1=\dfrac{0,4}{32}=0,0125\left(mol\right)\left(I\right)\)
Dung dịch C gồm HCl dư và FeCl2 với số mol là 2x .
Khí D gồm H2 và H2S .
Sục khí D từ từ vào dung dịch CuCl2 dư , chỉ có H2S phản ứng.
\(CuCl_2+H_2S\rightarrow CuS\downarrow+2HCl\left(4\right)\)
Kết tủa đen tạo thành là CuS
theo (1) (2) , (4) :
\(nCuS=x_1=\dfrac{4,8}{96}=0,05\left(mol\right)\left(II\right)\)
Kết hợp (I) ; và (II) ta có : x - x1= 0,0125
x = 0,0125 + 0,05 = 0,0625
Hiệu suất pứ tạo thành hh A:
Theo S: \(h\%=\dfrac{0,05}{0,0625}.100\%=80\%\)

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Làm hết r nhé Toàn mấy bài nâng cao khó vc
Nhờ j mà nhiều quá

1.Chi tiết câu hỏi: Nung hỗn hợp X gồm Zn và S ở nhiệt độ cao thu đư | BigSchool.vn
2.
Câu 2: Nung hỗn hợp gồm 5,6 gam bột Fe và 4,0 gam bột S ở nhiệt độ cao thu được chất rắn X. Cho X vào dung dịch HCl dư, khí thoát ra có tỷ khối so với H2 là 13,8 . Vậy hiệu suất của phản ứng giữa sắt và lưu huỳnh là:
A. 65% B. 80% C. 70% D. 75%

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M



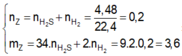
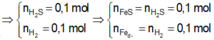
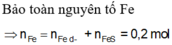
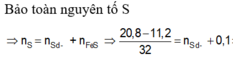
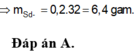
Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)