Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử có 1 mol Cu
=> mCu(bd) = 64 (g)
\(hh_{sau.pư}=64+\dfrac{1}{6}.64=\dfrac{224}{3}\left(g\right)\)
Gọi số mol Cu pư là a (mol)
PTHH: 2Cu + O2 --to--> 2CuO
a---------------->a
=> hh sau pư chứa \(\left\{{}\begin{matrix}CuO:a\left(mol\right)\\Cu:1-a\left(mol\right)\end{matrix}\right.\)
=> \(80a+64\left(1-a\right)=\dfrac{224}{3}\)
=> a = \(\dfrac{2}{3}\left(mol\right)\)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{64\left(1-\dfrac{2}{3}\right)}{\dfrac{224}{3}}.100\%=28,57\%\\\%m_{CuO}=\dfrac{80.\dfrac{2}{3}}{\dfrac{224}{3}}.100\%=71,43\%\end{matrix}\right.\)

Cái này sai đề rồi em, anh lập hệ pt mà bấm ra số mol âm
đúng anh à
em ra đc \(n_{Mg}=1,85\left(mol\right);n_{Al}=-\dfrac{16}{15}\left(mol\right)\)

2KMnO4-to->K2MnO4+MnO2+O2
0,126-------------0,063------0,063 mol
nKMnO4=20\158=0,126mol
=>mChất rắn=0,063.197+0,063.87=17,892g

CaCO3 --to--➢ CaO + CO2
\(n_{CaCO_3}=\dfrac{120}{100}=1,2\left(mol\right)\)
Theo PT: \(n_{CaO}=n_{CaCO_3}=1,2\left(mol\right)\)
\(\Rightarrow m_{CaO}=1,2\times56=67,2\left(kg\right)< 71,6kg\)
⇒ Chất rắn thu được sau phản ứng gồm: CaCO3 dư và CaO
\(m_{CO_2}=120-71,6=48,4\left(kg\right)\)
\(\Rightarrow n_{CO_2}=\dfrac{48,4}{44}=1,1\left(mol\right)\)
Theo PT: \(n_{CaCO_3}pư=n_{CO_2}=1,1\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}pư=1,1\times100=110\left(kg\right)\)
\(\Rightarrow m_{CaCO_3}dư=120-110=10\left(kg\right)\)
\(\Rightarrow m_{CaO}=71,6-10=61,6\left(kg\right)\)
\(\Rightarrow\%CaCO_3dư=\dfrac{10}{71,6}\times100\%=13,97\%\)
\(\%CaO=\dfrac{61,6}{71,6}\times100\%=86,03\%\)

Gọi \(n_{CaCO_3}=a\left(mol\right)\) và \(n_{MaCO_3}=b\left(mol\right)\)
PTHH: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
\(\Rightarrow m_{hh}=100a+84b=18,4\)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\Rightarrow a+b=0,2\left(mol\right)\)
\(\Rightarrow a=b=0,1\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=10g;m_{MgCO_3}=8,4g\)
\(\Rightarrow\%m_{CaCO_3}=\dfrac{100\%.10}{18,4}\approx54\%;\%m_{MgCO_3}=100\%-54\%=46\%\)
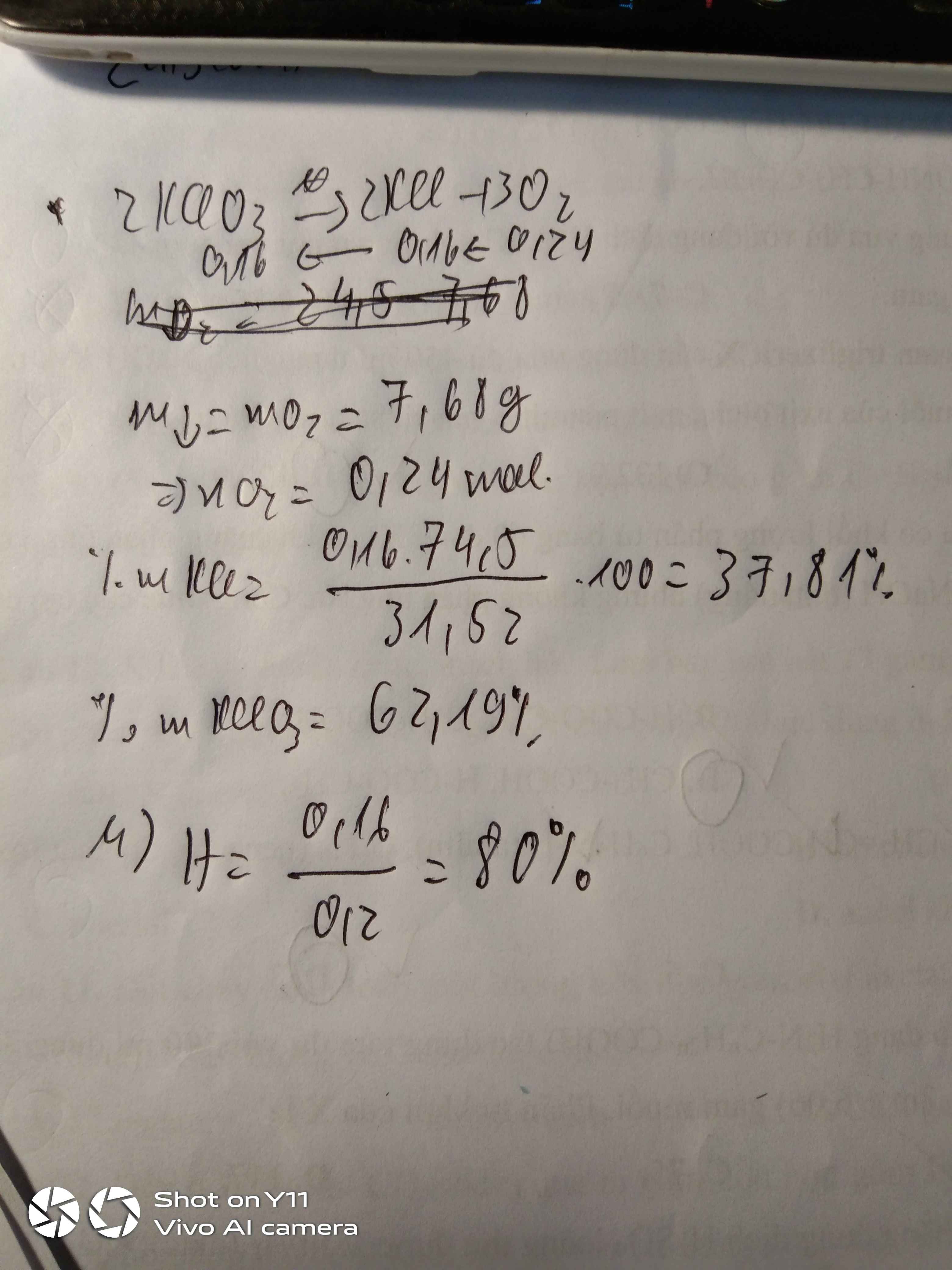
Thank you