Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) nh2=0,2; n CACO3=0,7
pt1: CH4+2O2 ---> CO2+2H2O
x x
pt2: C2H4 +3O2 ----> 2CO2+2H2O
y 2y
pt3: CO2+CA(OH)2 ----> CACO3+H2O
0,7 0,7
ta có hệ pt: x+y=0,2
x+2y=0,7
tự tìm
b) nbr2=1
pt: C4H6+ 2Br2 -----> C4H6Br4
0,05 0,1 0,05
tỉ lệ: 0,3/1 > 0,1/2 => C4H6 dư
CM C4H6Br2=0,05/8,72
CM C4H6 dư= 0,25/8,72

a) 4 P + 5 O2 = 2 P2O5
S + O2 = SO2
b) ta có nP2O5= 28.4/142= 0.2 (mol)
Mà nP2O5 gấp 2 lần nSO2 nên nSO2=0.2/2=0.1 (mol)
+) 4P +5O2 =2P2O5
0.4 0.5 <= 0.2 (mol)
+) S + O2 = SO2
0.1 0.1 <= 0.1 ( mol)
=> m hỗn hợp =0.1x 32+0.4x31=15.6 (g)
mà theo gthiet hỗn hợp ban đầu chứa 20% tạp chất nên khối lượng hỗn hợp thực tế ban đầu là m= 15.6+ 15.6x0.2=18.72 (g)
%m(P)=(0.4x31)/18.72= 66.24%
%m(S)=(0.1x32)/18.72=17.09%
c) tong n(O2)=0.5 + 0.1 =0.6 (mol)
=> V(O2) dktc =0.6x22.4 =13.44 (l)

+Có vẻ như bạn cân bằng sai thì phải (CH4 +2O2 =)CO2 +2)H2O

gọi số mol O2 là x
ptpu
O2 + 2H2 --> 2H2O
x ----> 2x
=>3x = 75 - 30 = 45
=> x = 15
Vì khí còn lại cháy được nên là O2
=> VH2= 2x = 30 ml => %VH2 = 40%
=> VO2 = 45ml => %VO2 = 60%
Đổi 75 ml = 0,075 l
Vì khí còn lại cháy được là \(H20\) trong O
ð V = 30 ml = 0,03l
2 +
Pt 44,8 (l) 22,4 (l) 44,8 (l) (1)
Đb 0,03L 0,015 L 0,03L
Từ (1) => V= 0,03 +0,03 = 0,06 L => % V= 100% =80%
V = 0,015 L => %V = 100% = 20%
Cô mình sửa rồi nha
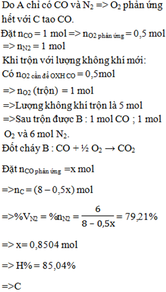


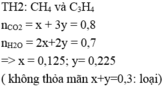



Gọi x,y là số mol của CO , H2
2CO + O2 -> 2CO2
x 1/2x
2H2 + O2 ->2H2O
y 1/2y
ta có hpt:\(\begin{cases}28x+2y=11.8\\\frac{1}{2}x+\frac{1}{2}y=0.35\end{cases}\) =>\(\begin{cases}x=0.4\\y=0.3\end{cases}\)
%m(CO)=(0.4*28*100)/11.8=94.9 %
% m(H2) = (0.3*2*100)/11.8=5.1%
Vì hỗn hợp ở thể khí nên :
%V(CO)=%n(CO)=(0.4*100)/0.7=57.14%
%V(H2)=%n(H2)=(0.3*100)/0.7=42.86%