Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Tại catot có thể lần lượt xảy ra các quá trình:
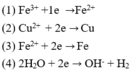
Tại anot có thể lần lượt xảy ra các quá trình:
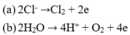
Sau khi điện phân A, cho dung dịch này phản ứng với NaOH thu được kết tủa B, nung B đến khối lượng không đổi thu được hỗn hợp 2 oxit. Trong A có 2 loại ion kim loại
Mặt khác, khi điện phân dung dịch A cho đến khi hết ion Cl - thì catot tăng 6,4 gam
⇒ Quá trình (2) đã xảy ra một phần, Cu 2 + vẫn còn trong dung dịch sau điện phân.
Gọi số mol Fe 3 + , Cu 2 + , Cl - , SO 4 2 - trong 100ml dung dịch A lần lượt là a,b,c,d.
Khi điện phân hết 
Theo bảo toàn e: số e do Fe3+ và Cu2+ nhận bằng số mol Cl- nhường. a + 0,1.2 = c (1)
Khối lượng dung dịch giảm gồm Cu2+ và Cl- đã phản ứng và bị tách ra khỏi dung dịch
6,4 + 35,5c = 17,05 (2)
Sau khi điện phân A, cho dung dịch này phản ứng với NaOH thu được kết tủa B, nung B đến khối lượng không đổi được 16 gam 2 oxit
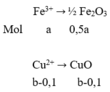
Suy ra: 160,0,5a + 80(b – 0,1) = 16 (3)
Theo định luật bảo toàn điện tích, đối với dung dịch A ta có:
3a + 2b = c + 2d (4)
Giải hệ phương trình ta được:
a = 0,1; b = 0,2; c= 0,3; d = 0,2
Khối lượng muối trong 100ml dung dịch A là 48,25 gam

Chọn C.
Ta có: ne = 0,12 mol ® Tại anot có khí Cl2 (x mol) và O2 (y mol) và tại catot có Cu (0,06 mol).
mà mdd giảm = 71x + 32y + 0,06.64 = 6,45 và 2x + 4y = 0,12 Þ x = 0,03 ; y = 0,015.
Dung dịch Y có chứa H2SO4 (0,015.2 = 0,03 mol) ; Na2SO4 (0,03 mol).
Khi cho 0,05 mol Fe(NO3)2 vào Y thì:
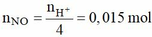
Dung dịch Z chứa Fen+ (0,05), Na+ (0,06), SO42- (0,06), NO3- (0,1 – 0,015 = 0,085) Þ m = 15,21 (g)

Đáp án D
![]()
Vì dung dịch Y vẫn còn màu xanh nên Y vẫn còn chứa Cu2+ chưa bị điện phân.
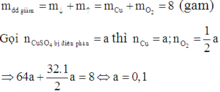
Khi cho Fe vào dung dịch Y có phản ứng:
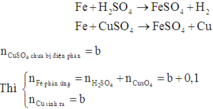
Theo định luật bảo toàn khối lượng, ta có:
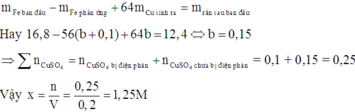



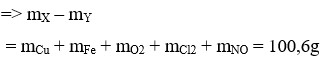
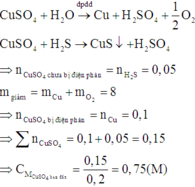


Đáp án A.