

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án D.
nCu 2+ = 0,2, ne = 0,15 => nHNO3 = 0,25, nCu = 0,075 => nNO = 0,05 => V = 1,12 lít

Đáp án B
Phần 1 :
Tại A(+) : 2Cl - → Cl2 + 2e
Tại K (-) : Cu2+ + 2e → Cu
Dd thu được tạo kết tủa với NaOH nên Cu2+ còn dư trong dung dịch
H+ + OH- → H2O
Cu2+ + 2OH- → Cu(OH)2
Số mol khí ở anot là : 0,14 mol(Cl2) → nCu (tạo thành ) =0,14.2 :2 =0,14 mol
Cho dung dịch NaOH vào thì
nCu(OH)2 = 1,96 : 98=0,02 mol→ dd sau phản ứng có H+ dư : 0,55.0.8-0,02.2=0,4 mol
→ phần 1 ban đầu có 0,16 mol Cu(NO3)2 và 0,4 mol HCl
Phần 2 :
3Fe + 8H+ + 2 NO3- → 3Fe2+ + 4H2O + 2NO
Ban đầu : 0,4 mol 0,32 mol
Sau PƯ 0 0,22 mol
Fe + Cu2+ → Fe2+ + Cu
0,16 mol
→ nFe phản ứng = 0,15 + 0,16 =0,31 mol
→ mrắn sau phản ứng = m – 0,31.56 + 0,16.64 =0,7 m→ m = 23,73

Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
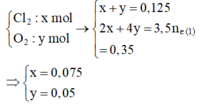
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 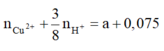
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).

Chọn đáp án B
- Ta có
n e t r a o đ ổ i = I t 96500 = 0 , 44 m o l
Quá trình điện phân xảy ra như sau:
| Tại anot |
Tại catot |
| C u 2 + + 2 e → C u 0 , 15 0 , 3 0 , 15 2 H 2 O + 2 e → 2 O H - + H 2 0 , 08 0 , 04 |
2 C l - → C l 2 + 2 e x → 2 x H 2 O → 4 H + + 4 e + O 2 4 x → y |
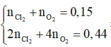

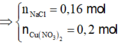
- Dung dịch sau điện phân chứa
![]()
+ Xét dung dịch sau điện phân có:
![]()
mol
- Cho m gam Fe tác dụng với dung dịch trên thì:
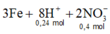
![]()
+ Theo đề ta có: m F e - m r ắ n k h ô n g tan = m F e tan
=> m - 0,8m = 0,09.56 => m = 25,2 (g)

Chọn B
Giả sử tại anot chỉ có Cl2 ⇒ nCl2 = 0,15 mol ⇒ ne = 0,3 mol < 0,44 mol ⇒ vô lí!.
⇒ khí gồm Cl2 và O2 với x và y mol || nkhí = x + y = 0,15 mol; ne = 2x + 4y = 0,44 mol.
⇒ giải hệ có: x = 0,08 mol; y = 0,07 mol ⇒ nNaCl = 0,16 mol ⇒ nCu(NO3)2 = 0,2 mol.
ne > 2nCu2+ ⇒ H2O bị điện phân tại catot ⇒ nOH– = 0,44 – 0,2 × 2 = 0,04 mol.
H+ + OH– → H2O ⇒ H+ dư 0,07 × 4 – 0,04 = 0,24 mol; nNO3– = 0,4 mol.
Xét Fe + dung dịch sau điện phân: do thu được rắn ⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2.
3Fe + 8H+ + 2NO3– → 3Fe2+ + 2NO + 4H2O ⇒ nFe phản ứng = 0,09 mol.
m – 0,09 × 56 = 0,8m ⇒ m = 25,2(g)

Chọn A.
Khí duy nhất thoát ra tại anot là Cl2 (0,14 mol) Þ ne = 0,28 mol Þ nCu = 0,14 mol
Dung dịch sau điện phân chứa Cu2+ dư và H+ (chưa điện phân)
⇒ C u N O 3 2 0 , 02 m o l H C l 0 , 04 m o l
Dung dịch X (tính cho P2) chứa HCl (0,8 mol) và Cu(NO3)2 (0,32 mol)
Khi cho Fe tác dụng với dung dịch trên thì:

Hỗn hợp rắn gồm: 64.0,32 + m – 56.0,62 = 0,75m Þ m = 56,96 (g)

Chọn B
Ta có: ne = (5.8492)/96500 = 0,44 mol. Đoán được anot sinh ra hai khí Cl2 (x mol), O2 (y mol).
x = 0,08; y = 0,07, nNaCl = 0,16 mol
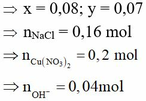
số mol H+ dư sau khi tmng hòa = 0,07.4 - 0,04 = 0,24 mol
Fe tác dụng với hỗn hợp sau phản ứng sẽ đẩy lên sắt 2.
Bảo toàn electron, ta được nFe phản ứng là 0,09.
Vậy ta có : m - 0,09.56 = 0,8m -> m = 25,2 gam.