Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\([H^+] = 10^{-2}M\Rightarrow n_{H^+} = 0,2.10^{-2} = 0,002(mol)\)
Anot :
\(2H_2O \to 4H^+ + O_2 + 4e\)
Catot :
\(Ag^+ + 1e \to Ag\)
BT e: \(n_{Ag} = n_{H^+} = 0,002(mol)\Rightarrow m_{Ag} = 0,002.108 = 0,216(gam)\)
Trả lời thắc mắc của bạn : Không thể diễn ra phản ứng điện phân nước tạo khí cùng lúc ở hai điện cực được bạn nhé (Vì đây là điện phân hoàn toàn)

Đáp án D.
Dung dịch sau có màu xanh nhạt nghĩa là vẫn còn ít ion đồng ⟹ H+ chưa bị điện phân.
Gọi số mol Cu2+ điện phân là a (mol) còn số mol O2 tạo ra ở anot là b (mol).
Bảo toàn e suy ra: a = 2b
Khối lượng dung dịch giảm gồm khối lượng Cu và khối lượng khí oxi sinh ra nên:
64a + 32b = 0,64
Từ hai phương trình trên suy ra: b = 0,004 (mol); a =0,008 (mol).
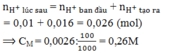

Chọn C
n(MgO) = 0,02; n(khí) = 0,02
Dung dịch sau điện phân có thể hòa tan MgO → có H2SO4
PTHH:
CuSO4 + 2KCl → Cu + Cl2 + K2SO4 1
x---------------------------- x mol
CuSO4 + H2O → Cu + H2SO4 + ½ O2 2
y------------------------------y ----------- y/2 mol
H2SO4 + MgO → MgSO4 + H2O
0,02 -------- 0,02 mol
Ta có hệ phương trình
1 n(khí) = x + y/2 = 0,02
2 n(H2SO4) = y = 0,02
Giải 1 2 có x = 0,01; y = 0,02
→ m(dung dịch giảm) = m(Cu) + m(Cl2) + m(O2) = 2,95 gam



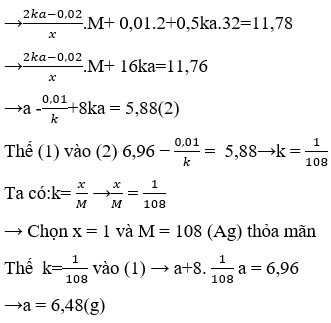




Đáp án B