Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nzn=0,1mol
a) có pt : Zn + 2Hcl -> ZnCl2 + H2
1 -> 2 -> 1 -> 1 mol
0,1-> 0,2 -> 0,1 -> o,1 mol
b) số Hcl đã dùng khi pứ là :
0,2 . 36,5= 7,3
-> số gam hcl dư là 10,95- 7,3=3,65(g)
c)mZnCl2=0,1 . 136=13,6g

Bài 1 :
a.
Kẽm + Axit clohidric => Kẽm clorua + Khí hidro
\(m_{Zn}+m_{HClk}=m_{ZnCl_2}+m_{H_2}\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b.
Áp dụng định luật bảo toàn khối lượng :
\(m_{Zn}+m_{HCl\left(bđ\right)}=m_{ZnCl_2}+m_{H_2}+m_{HCl\left(dư\right)}\)
c.
Ta có :
\(\dfrac{n_{Zn}}{1}=\dfrac{6.5}{65}=0.1< \dfrac{n_{HCl}}{2}=\dfrac{10.95}{2}=0.15\)
\(\Rightarrow\) \(\text{HCl dư }\)
\(n_{ZnCl_2}=n_{Zn}=0.1\left(mol\right)\)
\(m_{ZnCl_2}=0.1\cdot136=13.6\left(g\right)\)
\(d.\)
\(n_{HCl\left(pư\right)}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{HCl\left(pư\right)}=0.2\cdot36.5=7.3\left(g\right)\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=\dfrac{65}{65}=1\left(mol\right)\\ n_{ZnCl_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=1.136=136\left(g\right)\\ c.n_{H_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow V_{H_2}=1.22,4=22,4\left(l\right)\)

a) \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,25 0,5 0,5 0,5
Xét tỉ lệ : \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\) => Zn dư , HCl đủ
b) \(m_{Zn\left(dư\right)}=\left(0,3-0,25\right).65=3,25\left(g\right)\)
c) \(m_{ZnCl_2}=0,25.136=34\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ a,Zn+2HCl\rightarrow ZnCl_2+H_2\\b, Vì:\dfrac{0,5}{2}< \dfrac{0,3}{1}\Rightarrow Zndư\\ n_{Zn\left(dư\right)}=0,3-\dfrac{0,5}{2}=0,05\left(mol\right)\\ \Rightarrow m_{Zn\left(dư\right)}=0,05.65=3,25\left(g\right)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,25.136=34\left(g\right)\\ V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)

\(n_{Zn}=\dfrac{13}{65}=0,2(mol)\\ a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{HCl}=2n_{Zn}=0,4(mol)\\ \Rightarrow m_{HCl}=0,4.36,5=14,6(g)\\ c,n_{H_2}=n_{Zn}=0,2(mol)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48(l)\)
b) mHCl = 14,6 (g)
V H2 = 4,48 (l)
Giải thích các bước:
a) PTHH: Zn + 2HCl → ZnCl2 + H2↑
b) nZn = 13 : 65 = 0,2 mol
Theo PTHH: nHCl = 2.nZn = 0,4 mol
mHCl = 0,4 . 36,5 = 14,6(g)
c) nH2 = nZn = 0,2 mol
VH2 = 0,2 . 22,4 = 4,48 (l)

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.1.................................0.1\)
\(Đặt:n_{CuO\left(pư\right)}=x\left(mol\right)\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(x............x\)
\(m_{cr}=6-80x+64x=5.2\left(g\right)\)
\(\Rightarrow x=0.05\)
\(H\%=\dfrac{0.05}{0.075}\cdot100\%=66.67\%\)

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

Theo gt ta có: $n_{Zn}=0,1(mol);n_{CuO}=0,25(mol)$
a, $Zn+2HCl\rightarrow ZnCl_2+H_2$
$CuO+H_2\rightarrow Cu+H_2O$
b, Ta có: $n_{ZnCl_2}=0,1(mol)\Rightarrow m_{ZnCl_2}=13,6(g)$
b, Ta có: $n_{H_2}=0,1(mol)$
Sau phản ứng chất còn dư là CuO dư 0,15 mol
$\Rightarrow m_{CuO/du}=12(g)$
a)
$Zn + 2HCl \to ZnCl_2 + H_2$
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
b)
n ZnCl2 = n Zn = 6,5/65 = 0,1(mol)
=> m ZnCl2 = 0,2.136 = 13,6(gam)
c) n H2 = n Zn = 0,1 mol
CuO + H2 --to--> Cu + H2O
n CuO = 20/80 = 0,25 > n H2 = 0,1 nên CuO dư
n CuO pư = n H2 = 0,1 mol
=> m CuO dư = 20 - 0,1.80 = 12(gam)
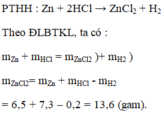
a. Kẽm + Axit Clohidric \(\rightarrow\) Kẽm Clorua + Hiđro
b. Vì HCl dư, có: \(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}+m_{HCl\left(\text{dư }\right)}\)
c. \(m_{ZnCl_2}=m_{Zn}+m_{HCl}-m_{H_2}-m_{HCl\left(\text{dư }\right)}=6,5+10,95-0,2-3,65=13,6g\)