Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học:
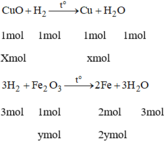
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
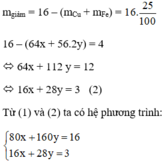
Giải hệ phương trình ta được:
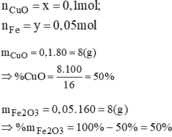

Fe2O3 + 3H2 -> 2Fe + 3H2O
CuO + H2 -> Cu + H2O
mKL=16-16.25%=12(g)
Đặt nFe2O3=a\(\Leftrightarrow\)160a
nCuO=b\(\Leftrightarrow\)80b
Ta cso hệ:
\(\left\{{}\begin{matrix}160a+80b=16\\56.2.a+64b=12\end{matrix}\right.\)
=>a=0,05;b=0,1
%mFe2O3=\(\dfrac{160.0,05}{16}.100\%=50\%\)
%mCuO=100-50%=50%

\(Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2\)
Gọi \(n_{Fe_2O_3\ pư} = a(mol)\)
Theo PTHH : \(n_{Fe} = 2n_{Fe_2O_3} = 2a(mol)\)
Ta có :
\(m_{hỗn\ hợp} = m_{Al_2O_3} + 160a(gam)\)
\(m_{rắn\ sau\ phản\ ứng} = m_{Al_2O_3} + m_{Fe} = m_{Al_2O_3} + 112a(gam)\)
Ta có :
\(m_{giảm} = 160a - 112a = 36,4(100\% - 86,813\%)\)
Suy ra : a = 0,1
Vậy : \(m_{Fe} = 0,1.2.56 = 11,2(gam)\)

he phuong trinh ay ban
1 cai theo % 1 cai theo g

\(m_{giảm}=m_O=3.84\left(g\right)\)
\(n_O=\dfrac{3.84}{16}=0.24\left(mol\right)\)
\(n_{H_2O}=n_O=0.24\left(mol\right)\)
\(m=0.24\cdot18=4.32\left(g\right)\)
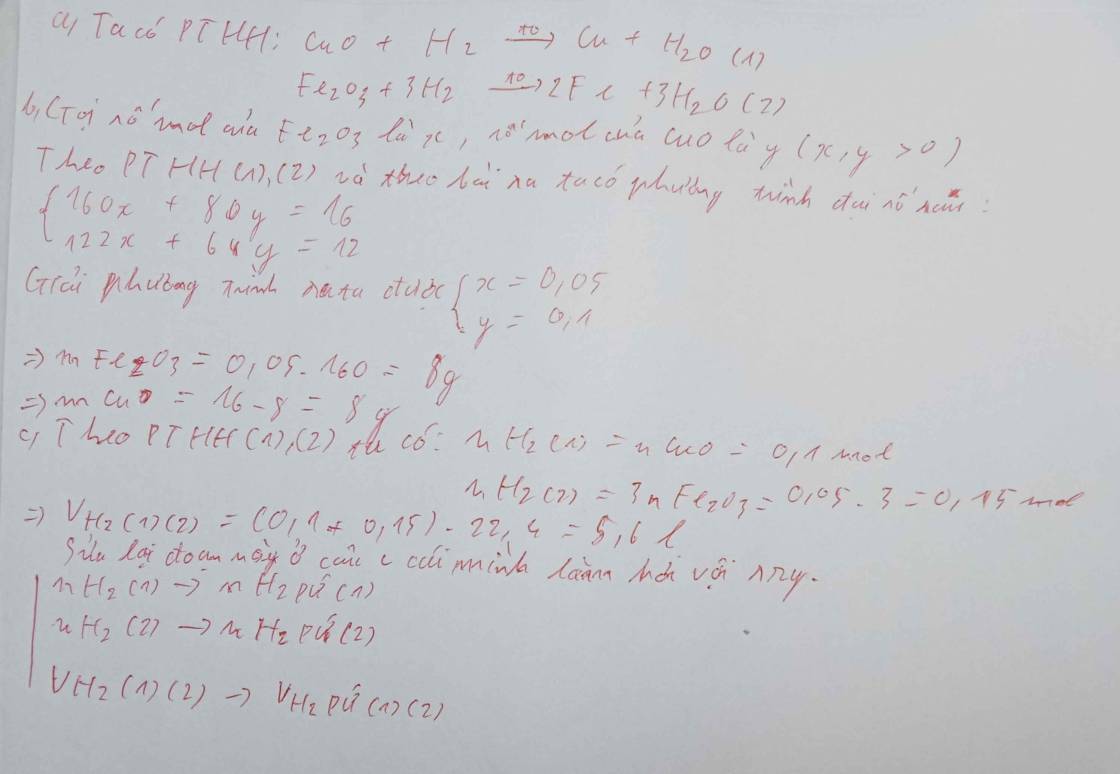
$m_{O\ trong\ oxit} = m_{giảm} = 20.24\%= 4,8(gam)$
$\Rightarrow n_O = \dfrac{4,8}{16} = 0,3(mol)$
Gọi $n_{Fe_2O_3} = a(mol) ; n_{CuO} = b(mol) \Rightarrow 160a + 80b = 20(1)$
Ta có : $n_O = 3a + b = 0,3(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,15
$\%m_{CuO} = \dfrac{0,15.80}{20}.100\% = 60\%$