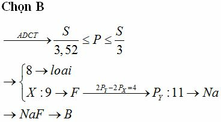Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a: Cấu tạo nguyên tử của A là 11 proton và 11 electron
Cấu hình: \(1s^22s^22p^63s^1\)
Vị trí: Chu kì 3, nhóm IA
b: A là kim loại vì có 1 e lớp ngoài cùng

Câu trả lời : D .X là 1 kim loại hoạt động yếu
Giải thích :
Nguyên tố X có hiệu số nguyên tử là 9. Điều khẳng định:
- Điện tích hạt nhân của nguyên tử là 9+, nguyên tử có 9 electron.- Nguyên tử X ở gần cuối chu kỳ 2, đầu nhóm VII.
- X là 1 phi kim hoạt động mạnh.
#Hóa học lớp 9 1

1. \(Cl_2+H_2\underrightarrow{t^o}2HCl\)
\(MnO_2+4HCl_đ\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O\)
\(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_{3\downarrow}+3NaCl\)
\(2NaCl+2H_2O\xrightarrow[cmn]{ddpddd\:}2NaOH+Cl_2+H_2\)
2. Cấu hình e: 1s22s22p63s23p4
→ Vị trí: - Ô 16 do số hiệu nguyên tử là 16.
- Chu kì 3 do có 3 lớp e.
- Nhóm VIA do thuộc nguyên tố nhóm p, có 6 e hóa trị.
→ Nguyên tố đó là phi kim do có 6 e hóa trị.
1. 3 PT đầu giống phần 1 ở trên bạn nhé.
\(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_{3\downarrow}+3KCl\)
\(2KCl+2H_2O\xrightarrow[cmn]{ddpddd\:}2KOH+Cl_2+H_2\)
2. - Cấu hình e: 1s22s22p63s23p1
→ Vị trí: - Ô 13 do số hiệu nguyên tử là 13.
- Chu kì 3 do có 3 lớp e.
- Nhóm IIIA do thuộc nguyên tố nhóm p, có 3 e hóa trị
→ Nguyên tố đó là kim loại do có 3 e hóa trị.

số e: 8
ĐTHN: 8+
số lớp e: 2
số e lớp ngoài cùng: 6
trong chu kì 2: N<O<F
trong nhóm VI: O>S

a.
X + 2HCl = XCl2 + H2
nX = nH2 = 5,6/22,4 = 0,25 mol
=> X = 6,082/0,25 = 24,328 (Mg)
b.
Mg có Z = 12
Gọi A1, A2, A3 lần lượt là số khối của 3 đồng vị
Tổng số khối của 3 đồng vị là 75
=> A1 + A2 + A3 = 75 (1)
Số khối của đồng vị thứ hai bằng trung bình cộng số khối của hai đồng vị kia
A2 = (A1 + A3)/2 => A1 - 2A2 + A3 = 0 (2)
Lấy (1) trừ (2) => 3A2 = 75 => A2 = 25 => N2 = A2 - Z = 25 - 12 = 13
Đồng vị thứ 3 có số neutron nhiều hơn đồng vị thứ 2 là 1 đơn vị
N3 - N2 = 1 => N3 = 1 + 13 = 14
=> A3 = 12 + 14 = 26
=> A1 = 75 - 26 - 25 = 24
Đồng vị 26Mg trong tự nhiên chiếm 11,4% số nguyên tử
=> %(24Mg, 25Mg) = 100% - 11,4% = 88,6%
Ta có : (88,6 - x)A1 + xA2 + 11,4A3 = 24,328.100
=> x = 10(%)
Vậy thành phần % của 3 đồng vị 24Mg, 25Mg và 26Mg lần lượt là
78,6%, 10% và 11,4%
c.
Giả sử có 100 nguyên tử Mg thì sẽ có
78,6 nguyên tử 24Mg ; 10 nguyên tử 25Mg ; 11,4 nguyên tử 26Mg
Vậy nếu có 50 nguyên tử 25Mg thì sẽ có
393 nguyên tử 24Mg và 57 nguyên tử 26Mg