Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 Z + n H 2 S O 4 → Z 2 S O 4 n + n H 2
Ta có:
m Z + m S O 4 2 - = m m u o i
m S O 4 2 - = m m u o i - m Z
= 6,84-1,08=5,76g
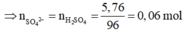
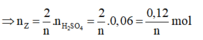
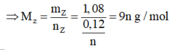
Thử chọn lần lượt n=1, 2, 3 ta được Z là kim loại Al hóa trị III
⇒ Chọn C.

Do tính khử Zn > Fe nên Zn phản ứng trước.
Do khối lượng rắn khan ở thí nghiệm 2 > thí nghiệm 1.
Do đó, ở thí nghiệm 1 HCl hết, kim loại có thể dư. Ở thí nghiệm 2, kim loại hết, HCl có thể dư.
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{Zn} = a ; n_{Fe} = b\\ m_A = 65a + 56b = 18,6\\ m_{chất\ rắn} = 136a + 127b = 39,9\\ \Rightarrow a = 0,2; b = 0,1\\ \Rightarrow m_{Zn} = 0,2.65 = 13(gam) ; m_{Fe} = 0,1.56 = 5,6(gam)\)
Thí nghiệm 1 :
\(n_{Fe\ pư} = x(mol) ; n_{Fe\ dư} = y(mol)\\ \Rightarrow x + y = 0,1(1)\\ n_{FeCl_2} = x (mol)\\ \Rightarrow m_{chất\ rắn} = 0,2.136 + 127x + 56y = 34,575(2)\\ (1)(2)\Rightarrow x = 0,025 ; y = 0,075\\ n_{HCl} = 2n_{Zn} + 2n_{Fe\ pư} = 0,2.2 + 0,025.2 = 0,45(mol)\\ C_{M_{HCl}} = \dfrac{0,45}{0,5} = 0,9M\)

-Vì khối lượng hỗn hợp kim loại ở 2 trường hợp đều bằng nhau. Chỉ thay đổi lượng HCl. Do trường hợp 800ml HCl thì khối lượng chất rắn tăng lên nên nếu với 500ml HCl mà kim loại hết thì khi tăng lên 800ml HCl thì khối lượng chất rắn không thể tăng lên nữa nên:
-Trường hợp 500ml HCl thì hỗn hợp kim loại dư, HCl hết.
-Trường hợp 500ml HCl thì hỗn hợp kim loại hết, HCl dư.
-Ta sẽ tìm khối lượng mỗi kim loại trong trường hợp 800ml HCl:
-Gọi \(n_{Zn}=x;n_{Fe}=y\)
Zn+2HCl\(\rightarrow\)ZnCl2+H2
Fe+2HCl\(\rightarrow\)FeCl2+H2
Chất rắn thu được là ZnCl2 x mol và FeCl2 y mol
hệ: \(\left\{{}\begin{matrix}65x+56y=18,6\\136x+127y=39,9\end{matrix}\right.\)
giải ra x=0,2 và y=0,1
mZn=65.0,2=13gam; mFe=56.0,1=5,6gam
-Tính nồng độ mol HCl theo trường hợp 500ml HCl vì HCl phản ứng hết.
Cứ 1 mol hỗn hợp kim loại tạo 1 mol hỗn hợp muối thì tăng 71 gam
Vậy x mol hỗn hợp kim loại tạo x mol hỗn hợp muối thì tăng 34,575-18,6=15,975 gam
\(\rightarrow x=\dfrac{15,975}{71}=0,225mol\)
\(\rightarrow n_{HCl}=2x=0,45mol\rightarrow C_{M_{HCl}}=\dfrac{0,45}{0,5}=0,9M\)
Ngoài ra còn có thể tính cách khác nữa!bạn tự tham khảo nhé!

X có dạng \(RCOOH\)
\(18gX+\left\{{}\begin{matrix}KOH:0,3mol\\NaOH:0,3mol\end{matrix}\right.\rightarrow41,4gCRắn+H_2O\)
\(n_{bazo}=n_{OH^-}=0,6mol\)
\(BTKL:m_{H_2O}=18+0,3\cdot56+0,3\cdot40-41,4=5,4g\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3mol< n_{bazo}=0,6mol\)
Mà axit cacboxylic đơn chức\(\Rightarrow n_X=0,3mol\)
\(\Rightarrow M_X=\dfrac{18}{0,3}=60\Rightarrow M_R+12+16\cdot2+1=60\)
\(\Rightarrow M_R=15\Rightarrow CH_3\)
Vậy axit cần tìm là \(CH_3COOH\)
TK
Bài 1 :
Áp dụng định luật bảo toàn khối lượng, ta có :
mH2 = 15,6 + 9,2 - 24,5 = 0,3g => nH2 = 0,3/2 = 0,15 mol
Gọi CxHyOH là công thức chung của 2 rượu, ta có :
CxHyOH => 1/2H2
n(rượu) = 2nH2 = 2.0,15 = 0,3 mol
=> M(rượu) = 15,6/0,3 = 52
=> CxHy = 52 - 17 = 35 => x = 35/12 = 2,9 (do y nhỏ, không đáng kể)
Vậy trong 2 rượu sẽ có 1 rượu có 2C và 1 rượu có 3C
=> 2 rượu cần tìm có công thức là C2H5OH và C3H7OH
* Rượu có 2C không thể là rượu không no được vì CH2=CH-OH không bền sẽ phân hủy thành CH3CHO



-mình không có lí thuyết rõ ràng nhưng mà cô cạn dung dịch cứ hiểu nôm na là làm khô đi ấy, làm bay hơi hết nước trong dung dịch, giống như nước biển đem đi cô cạn thì còn lại muối ấy.
-axit cô cạn được nha bạn vd như:
-HCl , HNO3 bay hơi HNO3 có thể bị phân hủy thành khí NO2 và H2O
-H2SO4 ko bay hơi, là chất lỏng sánh như dầu
Muốn biết chi tiết hơn thì phải đọc thêm sách, sgk lớp 11 12 có đấy
-cô cạn thì mình nghĩ là cái nào là dung dịch (lỏng) thì đều cô cạn được
ko biết có đúng không nữa!!!
- Cô cạn dung dịch là làm bay hơi hết NƯỚC có trong dung dịch
+) Đối với dung dịch muối, khi cô cạn sẽ còn lại MUỐI KHAN hoặc MUỐI NGẬM NƯỚC ở dạng cặn trắng
+) Đối với dung dịch kiềm và H2SO4 khi cô cạn sẽ còn lại dung dịch lỏng sánh (đặc) , không bay hơi hết
+) Đối với dung dịch axit HCl khi cô cạn bay hơi hết
+) Đối với HNO3 khi cô cạn sẽ đồng thời bị nhiệt phân ( 4HNO3 -to \(\rightarrow\) 4NO2 + O2 + 2H2O )