Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cl_2} = a(mol) ; n_{O_2} = b(mol)\\ n_{Al} = \dfrac{8,1}{27} = 0,3(mol) ; n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)\\ \text{Bảo toàn e : } 2a + 4b = 0,3.3 + 0,1.2 = 1,1(1)\\ m_{khí} = 71a + 32b = 37,15 - 8,1 - 6,5 = 22,55(2)\\ (1)(2) \Rightarrow a = 0,25 ; b = 0,15\\ \%n_{O_2} = \dfrac{0,15}{0,25 + 0,15}.100\% = 37,5\%\)

Gọi \(n_{Mg} = a(mol) ; n_{Al} = b(mol)\\ \Rightarrow 24a + 27b = 5,7(1)\)
\(Mg^0 \to Mg^{+2} + 2e\\ Al^0 \to Al^{+3} + 3e\\ O_2 + 4e \to 2O^{-2}\\ Cl_2 + 2e \to 2Cl^-\)
Bảo toàn electron : \(2n_{Mg} + 3n_{Al} = 2a + 3b = 4n_{O_2} + 2n_{Cl_2} = 1,2(mol)\)(2)
Từ (1)(2) suy ra : a = -0,85< 0 ⇒ Sai đề
X{Mg, Al} + {Cl2, O2} → Z
Áp dụng định luật BTKL: mCl2 + mO2 = mZ – mX = 19,7 – 7,8 = 11,9 gam
Theo đề bài ta có hệ phương trình:
⎧⎪⎨⎪⎩nCl2+nO2=5,622,4=0,2571nCl2+32nO2=11,9→{nCl2=0,1nO2=0,15{nCl2+nO2=5,622,4=0,2571nCl2+32nO2=11,9→{nCl2=0,1nO2=0,15
Đặt số mol của Mg và Al lần lượt là x và y (mol)
- Khối lượng hỗn hợp: 24x + 27y = 7,8 (1)
- Bảo toàn e: 2nMg + 3nAl = 2nCl2 + 4nO2 => 2x + 3y = 0,1.2 + 0,15.4 hay 2x + 3y = 0,8 (2)
Giải (1) và (2) thu được x = 0,1 và y = 0,2
=> %mAl = 0,2.27/7,8 = 69,23%

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
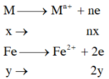
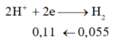
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
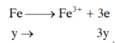
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C

$n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)$
$n_{Al} = \dfrac{8,1}{27} = 0,3(mol)$
Gọi $n_{Cl_2} = a(mol) ; n_{O_2} = b(mol)$
Ta có :
Bảo toàn khối lượng $\to 4,8 + 8,1 + 71a + 32b = 37,05$
Bảo toàn electron $0,2.2 + 0,3.3 = 2a + 4b$
Suy ra : a = 0,25 ; b = 0,2
$\%V_{Cl_2} = \dfrac{0,25}{0,25 + 0,2}.100\% = 55,56\%$





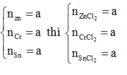

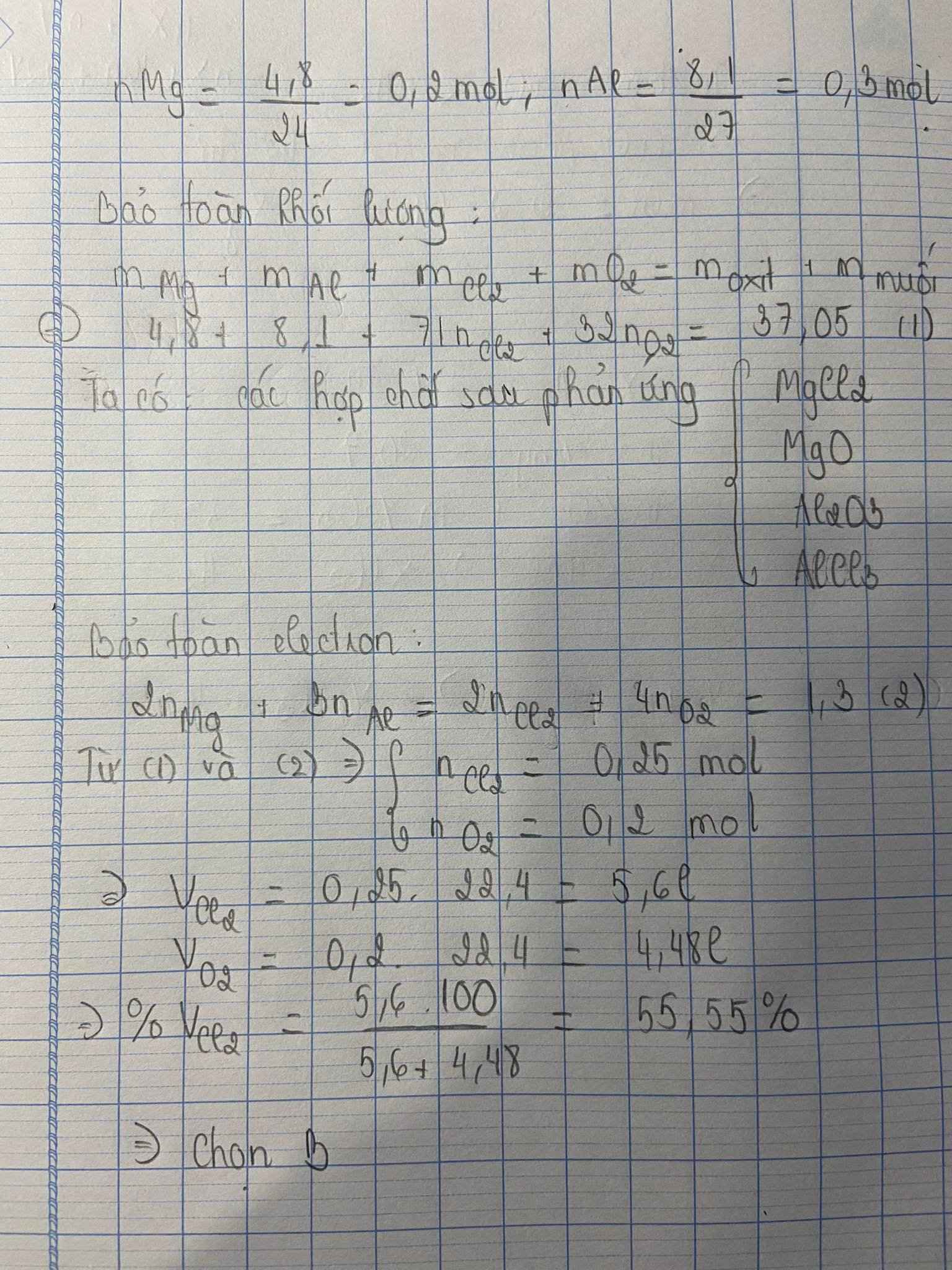
Có mAl + mZn = 1,84
=> 27nAl + 65nZn = 1,84 (I)
Có nAl : nZn = 1:1 => nAl = nZn
=> nAl - nZn = 0 (II)
(I);(II) => nAl = 0,02(mol) ; nZn = 0,02 (mol)
Gọi nCl2 = a(mol) , nO2 = b(mol)
Áp dụng định luật bảo toàn khối lượng
mkim loại + mB = moxit và muối
=> 1,84 + mB = 4,29
=> mB = 2,45 (g)
=> mCl2 + mO2= 2,45
=> 71a + 32b = 2,45 (III)
quá trình oxi hóa
Al0 => Al+3 +3e
0,02 0,06(mol)
Zn0 => Zn+2 +2e
0,02 0,04(mol)
quá trình khử
Cl20 + 2e => 2Cl-1
a 2a (mol)
O20 + 4e => 2O-2
b 4b (mol)
Áp dụng định luật bảo toàn mol e
=> 2a + 4b = 0,04 + 0,06 = 0,1 (IV)
(III);(IV) = > a = 0,03 ; b = 0,01
=> nB = 0,03 + 0,01 = 0,04 (mol)
=> VB = 0,04.22,4 = 0,896 (l)