Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
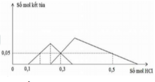
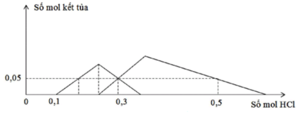
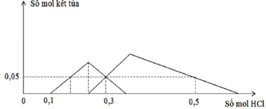
TN1 : Nhỏ từ từ HCl vào hỗn hợp x mol NaOH và y mol Na2ZnO2 ta thấy tới 0,1 mol HCl mới thấy xuất hiện kết tủa. Do vậy 0,1 mol HCl này dùng để trung hoà NaOH →x=0,1.
Khi dùng 0,3 mol HCl thì thu được 0,05 mol kết tủa Zn(OH)2 và đồ thị đang đi xuống tức đang hoà tan kết tủa.
Để toạ thành kết tủa lúc đồ thị đi lên thì cần 0,1 +0,05.2=0,2 mol HCl.
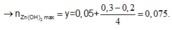
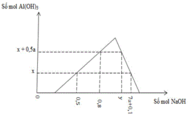
TN2 : Cho HCl vào z mol Ba(OH)2 và t mol Ba(AlO2)2.
Khi dùng tới 0,3 mol HCl mới chỉ xuất hiện 0,05 mol kết tủa Al(OH)3 trong lúc đang tạo kết tủa.
Do vậy ![]()
Khi dùng 0,3 hay 0,5 mol đều thu được 0,05 mol kết tủa
![]()

Đáp án B
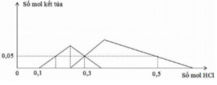
TN1 : Nhỏ từ từ HCl vào hỗn hợp x mol NaOH và y mol Na2ZnO2 ta thấy tới 0,1 mol HCl mới thấy xuất hiện kết tủa. Do vậy 0,1 mol HCl này dùng để trung hoà NaOH → x = 0,1.
Khi dùng 0,3 mol HCl thì thu được 0,05 mol kết tủa Zn(OH)2và đồ thị đang đi xuống tức đang hoà tan kết tủa.
Để toạ thành kết tủa lúc đồ thị đi lên thì cần 0,1 +0,05.2=0,2 mol HCl.
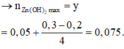
TN2 : Cho HCl vào z mol Ba(OH)2 và t mol Ba(AlO2)2.
Khi dùng tới 0,3 mol HCl mới chỉ xuất hiện 0,05 mol kết tủa Al(OH)3 trong lúc đang tạo kết tủa.
Do vậy
![]()
Khi dùng 0,3 hay 0,5 mol đều thu được 0,05 mol kết tủa
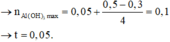

Chọn đáp án D.
Các thí nghiệm có kết tủa là:
a – b – c – f – g. Các thí nghiệm
d và e ban đầu có kết tủa nhưng
bị tan.
(a). Có kết tủa Cu(OH)2.
(b). Có kết tủa CuS.
(c). Có kết tủa BaSO4.
(f). Có kết tủa BaSO4.

Đáp án : B
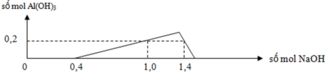
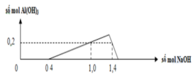
+) Tại nNaOH = 0,4 mol thì trung hòa vừa hết axit
=> x = 0,2 mol
Tại nNaOH = 1 mol => Al3+ dư
Tại nNaOH = 1,4 mol thì kết tủa tan 1 phần
n A l ( O H ) 3 = 4 n A l 3 + - n N a O H - n H C l
⇒ n A l 3 + = 0 , 3 m o l
=> y = 0,15 mol
Nếu thêm n B a O H 2 = 0 , 05 m o l vào X :
=> Kết tủa : 0,2 mol Al(OH)3 và 0,5 mol BaSO4
=> m = 132,1g

Đáp án C
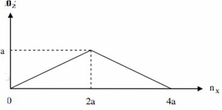
Đồ thị trải qua các giai đoạn:
+Giai đoạn chưa xuất hiện kết tủa do NaOH tác dụng với H2SO4.
+Kết tủa tăng dần đến cực đại do NaOH tác dụng với Al2(SO4)3tạo kết tủa Al(OH)3.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3.
![]()
Nhận thấy lúc 1 mol NaOH phản ứng và 1,4 mol NaOH phản ứng đều thu được cùng một lượng kết tủa, chứng tỏ 0,4 mol NaOH chênh lệch đã tạo 1 lượng kết tủa và hòa tan lượng kết tủa đó.
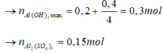
Cho 0,7 mol Ba(OH)2 vào X thì kết tủa thu được gồm BaSO40,65 mol và Al(OH)3.
![]()
Vậy m=167,05 gam

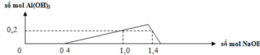
Đồ thị trải qua các giai đoạn:
+Giai đoạn chưa xuất hiện kết tủa do NaOH tác dụng với H2SO4.
+Kết tủa tăng dần đến cực đại do NaOH tác dụng với Al2(SO4)3tạo kết tủa Al(OH)3.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3.
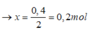
Nhận thấy lúc 1 mol NaOH phản ứng và 1,4 mol NaOH phản ứng đều thu được cùng một lượng kết tủa, chứng tỏ 0,4 mol NaOH chênh lệch đã tạo 1 lượng kết tủa và hòa tan lượng kết tủa đó.
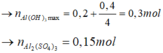
Cho 0,7 mol Ba(OH)2 vào X thì kết tủa thu được gồm BaSO40,65 mol và Al(OH)3.
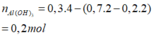
Vậy m=167,05 gam

Chọn A
Khi cho dd OH- vào hỗn hợp gồm H+ và muối Al3+
Sẽ xảy ra các phản ứng hóa học theo thứ tự sau:
(1) OH- + H+ → H2O
(2) OH- + 3Al3+ → Al(OH)3↓
(3) OH- + Al(OH)3↓ → AlO2- + 2H2O
Khi phản ứng (1) kết thúc , bắt đầu xảy ra (2) thì xuất hiện kết tủa => đồ thị bắt đầu đi lên
Khi đồ thị đi lên từ từ đến điểm cực đại => xảy ra phản ứng (1) và (2)
Ta có công thức nhanh: nOH- = 3n↓ + nH+
Khi đồ thị bắt đầu đi xuống => phản ứng (3) xảy ra, kết tủa bắt đầu bị hòa tan dần dần đến hết
=> Ta có công thức tính nhanh: nOH- = 4nAl3+ - n↓ + nH+
Từ đây ta có các phương trình sau:
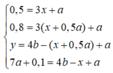
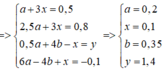
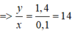


Đáp án D