Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b, \(n_{MgCl_2}=0,2.0,25=0,05\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,05\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,05.40=2\left(g\right)\)
c, \(n_{NaOH}=2n_{MgCl_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{ddNaOH}=\dfrac{0,1.40}{15\%}=\dfrac{80}{3}\left(g\right)\)

Cho 500ml dung dịch MgCl2 tác dụng vừa đủ với 30g NaOH. Phản ứng xog tiếp tục nung lấy kết tủa đến khối lượng không đổi thì thu được 1 chất rắn.Hãy:
a, Viết PTHH
b, Tính khối lượng chất rắn thu được sau khi nung kết tủa
c, Tính nồng độ mol dung dịch MgCl2 đã dùng
---------------------------------------------------------------------------------------------------------------------
a) PTHH :
(1) \(MgCl2+2NaOH->Mg\left(OH\right)2\downarrow+2NaCl\)
(2) \(Mg\left(OH\right)2-^{t0}->MgO+H2O\)
b) Theo de bai ta co : nNaOH = \(\dfrac{30}{40}=0,75\left(mol\right)\)
Theo PTHH ta co :
nMgO = nMg(OH)2 = 1/2nNaOH = 0,375 mol
=> mMgO = 0,375.40 = 15 (g)
c) Theo PTHH : nMgCl2 = nMg(OH)2 = 0,375 mol
=> Nồng độ mol dung dịch MgCl2 đã dùng
CM\(_{ddMgCl2\left(da-dung\right)}=\dfrac{0,375}{0,5}=0,75\left(M\right)\)
MgCl2 + 2NaOH -> 2NaCl + Mg(OH)2 (1)
Mg(OH)2 -to->MgO + H2O (2)
nNaOH=\(\dfrac{30}{40}=0,75\left(mol\right)\)
Theo PTHH 1 ta có:
nMgCl2=nMg(OH)2=\(\dfrac{1}{2}\)nNaOH=0,375(mol)
Theo PTHH 2 ta có:
nMg(OH)2=nMgO=0,375(mol)
mMgO=0,375.40=15(g)
CM dd MgCl2=\(\dfrac{0,375}{0,5}=0,75M\)

\(n_{CuSO_4}=0,5mol\)
\(n_{KOH}=0,3mol\)
a) \(CuSO_4+2KOH\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
0,5 0,3 0,3 0,3
\(Cu\left(OH\right)_2\underrightarrow{t^O}CuO+H_2O\)
0,3 0,3
b)\(m_{CuO}=0,3\cdot80=24\left(g\right)\)
c) \(m_{K_2SO_4}=0,3\cdot174=52,2\left(g\right)\)

$n_{CuSO_4} = \dfrac{80}{160} = 0,5(mol) ; n_{KOH} = \dfrac{16,8}{56} = 0,3(mol)$
\(CuSO_4+2KOH\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
Ban đầu : 0,5 0,3 (mol)
Phản ứng : 0,15 0,3 (mol)
Sau phản ứng: 0,35 0 0,35 0,35 (mol)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
0,35 0,35 (mol)
$m_{CuO} = 0,35.80 = 28(gam)$
c)
$m_{CuSO_4\ dư} = 0,35.160 = 56(gam)$
$m_{K_2SO_4} = 0,15.174 = 26,1(gam)$
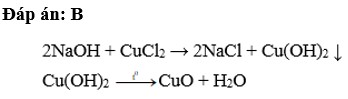
FeCl2+2KOH➡ Fe(OH)2+2KCl
mKOH=112✖ 20%=22,4g
➡ nKCl=0,4mol
➡ nFe(OH)2=0,2mol
mFe(OH)2=0,2✖ 90=18g
mKCl=0,2✖ 74,5=14,9g
Fe(OH)2➡ FeO+H2O
nFe(OH)2=0,2mol➡ nFeO=0,2mol
mFeO=0,2✖ 72=14,4g