Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D.
Các thí nghiệm có kết tủa là:
a – b – c – f – g. Các thí nghiệm
d và e ban đầu có kết tủa nhưng
bị tan.
(a). Có kết tủa Cu(OH)2.
(b). Có kết tủa CuS.
(c). Có kết tủa BaSO4.
(f). Có kết tủa BaSO4.

Đáp án C
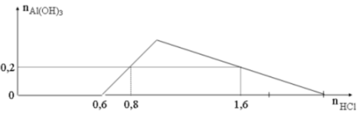
Từ đồ thị dễ dàng thấy được
nNaOH = x = 0,6 mol.
Tại thời điểm nHCl = 0,8 mol
Ta thấy nAl(OH)3 = 0,2 mol.
Ta có:
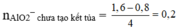
⇒ ∑nAlO2– = 0,2 + 0,2 = y = 0,4 mol.
⇒ nNaAlO2 = 0,4 mol
⇒ x + y = 1 mol

Đáp án A
Thứ tự phản ứng: H+ + OH- → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
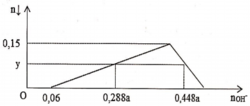
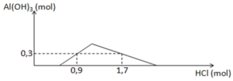
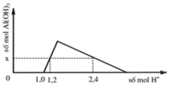
- Tại: nH+ = 1,0 mol => bắt đầu có kết tủa => Phản ứng trung hòa hoàn toàn => nOH = 1 mol = a
- Tại nH+ = 1,2 mol => chưa có hiện tượng hòa tan kết tủa => nAl(OH)3 = nH+ pứ = 1,2 – 1 = 0,2 mol
- Tại nH+ = 2,4 mol => có hiện tượng hòa tan 1 phần kết tủa => nAl(OH)3 = 1/3.(4nAlO2 – nH+ pứ)
=> 0,2 = 1/3.[4b – (2,4 – 1,0)] => b = 0,5 mol
=> (a + b) = 1,5 mol

Đáp án B
Thứ tự phản ứng: H+ + OH- → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
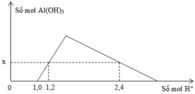
- Tại: nH+ = 1,0 mol => bắt đầu có kết tủa => Phản ứng trung hòa hoàn toàn => nOH = 1 mol = a
- Tại nH+ = 1,2 mol => chưa có hiện tượng hòa tan kết tủa => nAl(OH)3 = nH+ pứ = 1,2 – 1 = 0,2 mol
- Tại nH+ = 2,4 mol => có hiện tượng hòa tan 1 phần kết tủa => nAl(OH)3 = 1/3.(4nAlO2 – nH+ pứ)
=> 0,2 = 1/3.[4b – (2,4 – 1,0)] => b = 0,5 mol
=> (a + b) = 1,5 mol
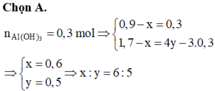
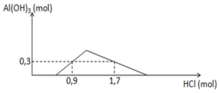
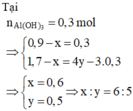
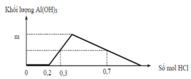
Đáp án C
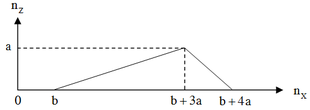
Dựa vào đồ thị, ta thấy: Khi cho từ từ X vào dung dịch Y, phản ứng thứ nhất không tạo ra kết tủa, phản ứng này cần dùng b mol X. Phản ứng thứ hai bắt đầu tạo kết tủa Z và tăng dần đến cực đại là a mol, phản ứng này cần 3a mol X. Cuối cùng kết tủa Z bị hòa tan từ từ đến hết, phản ứng này cần a mol chất X.
Suy ra: Đây là thí nghiệm cho từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm HCl và Al(NO3)3.
Phương trình phản ứng:
N a O H + H C l → N a C l + H 2 O ( 1 ) m o l : b ← b 3 N a O H + A l ( N O 3 ) 3 → A l ( O H ) 3 ↓ + 3 N a N O 3 ( 2 ) m o l : 3 a ← a → a N a O H + A l ( O H ) 3 → N aA l O 2 + 2 H 2 O ( 3 ) m o l : a ← a