Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt x và y lần lượt là số mol O3 và O2 trong hỗn hợp
2O3 → 3O2
Trước phản ứng : (x + y) mol hỗn hợp
Sau phản ứng: (x+ 3/2y) mol
Số mol tăng là: (x+ 3/2y) - (x +y) = 0,5y.
b) Ta có; 0,5y ứng với 2% nên y ứng với 4%
vậy O3 chiếm 4%, O2 chiên 96%.

Lời giải.
a) Khí hiđro sunfua H2S và khí lưu huỳnh đioxit SO2 không cùng tồn tại trong một bình chứa vì H2S là chất khử mạnh, SO2 là chất oxi hóa.
2H2S + SO2 -> 3S + 2H2O.
b) Khí oxi O2 và khí Cl2 có thể tồn tại trong một bình chứa vì O2 không tác dụng trực tiếp với Cl2.
c) Khí HI và Cl2 không tồn tại trong cùng một bình chứa vì Cl2 là chất oxi hóa mạnh và HI là chất khử mạnh.
Cl2 + 2HI -> 2HCl + I2.

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Những phản ứng sau là phản ứng oxi hóa khử:
.jpg)
.png)
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) .png) + 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
+ 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
CaOCl2: phân tử tự oxi hóa khử, HCl đóng vai trò môi trường
.jpg)
.png) Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
.jpg)
.png)
HCl là chất khử, KClO3 là chất oxi hóa
.jpg)

CaOCl2: phân tử tự oxi hóa

a) (1) 2КСЮ3 \(\rightarrow\) 2KCl + 3O2 ; (2) S + O2 —> SO2
(3) SO2 + 2NaOH \(\rightarrow\) Na2SO3 + H2O
Phản ứng oxi hoá – khử là (1) và (2).
b) (1) S + H2 \(\rightarrow\) H2S ; (2) 2H2S + 3O2 \(\rightarrow\)2SO2 + 2H2O
(3) 2SO2 + O2 \(\rightarrow\) 2SO3 ; (4) SO3 + H2O \(\rightarrow\) H2SO4
Phản ứng oxi hoá – khử là : (1); (2); (3).

Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)
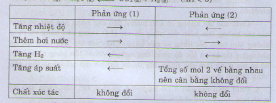
Đáp án D
A tăng nồng độ O2, cân bằng chuyển dịch theo chiều làm giảm nồng độ oxi tức chiều thuận
B giảm nhiệt độ bình phản ứng tương ứng cân bằng chuyển dịch theo chiều tỏa nhiệt tức chiều thuận
C tăng áp suất chung của hh cân bằng chuyển dịch theo chiều làm giảm áp suất tức chiều thuận
D giảm nồng độ khí SO2 cân bằng chuyển dịch theo chiều làm tăng nồng độ khí SO2 tức chiều nghịch
Đáp án D