Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

KH nguyến tố halogen là X , đặt a là số mol ptu X2
ptpu:
Mg + X2 ----> MgX2
mol : a−−>a
2Al + 3X2 ---> 2AlX3
mol: a−−−>\(\frac{2a}{3}\)
từ pt => (24 + 2X).a =19 => a=\(\frac{19}{24+2X}\)
(27 + 3X).1,5a =17,8 => a= \(\frac{17,8.3}{\left(27+3X\right).2}\) =>X=35,5
![]()

a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
Mg + X2 → MgX2
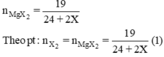
2Al + 3X2 → 2AlX3.
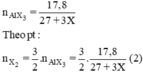
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) Thay X = 35,5 vào (1) ⇒ nCl2 = 0,2 mol ⇒ mCl2 = 14,2g.

a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
2Al + 3X2 \(\rightarrow\) 2AlX3.
nAlX3 = 17,8/(27+3X).
nX2 = 3.17,8/ 2(27+3X). (1)
Mg + X2 \(\rightarrow\)MgX2
nMgX2 = 19 /(24 + 2X).
nX2 = 19/ (24+ 2X) (2).
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) mCl2 = 14,2g.
a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
2Al + 3X2 →→ 2AlX3.
nAlX3 = 17,8/(27+3X).
nX2 = 3.17,8/ 2(27+3X). (1)
Mg + X2 →→MgX2
nMgX2 = 19 /(24 + 2X).
nX2 = 19/ (24+ 2X) (2).
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) mCl2 = 14,2g.

\(m_{HX}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HX --> 2AlX3 + 3H2
0,2--->0,6-------------->0,3
=> \(M_{HX}=\dfrac{21,9}{0,6}=36,5\left(g/mol\right)\)
=> X là Cl
VH2 = 0,3.22,4 = 6,72(l)

\(AlX_3+3AgNO_3\rightarrow3AgX+Al\left(NO_3\right)_3\)
\(2AgX\rightarrow2Ag+X_2\)
Ta có :
\(n_{Ag}=\frac{32,4}{108}=0,3\left(mol\right)\)
\(\Rightarrow n_{AgX}=n_{Ag}=0,3\left(mol\right)\)
\(\Rightarrow n_{AgX3}=0,1\left(mol\right)\)
\(M_{AgX3}=\frac{13,35}{0,1}=133,5\left(\frac{g}{mol}\right)\)
\(\Rightarrow M_X=35,5\left(\frac{g}{mol}\right)\)
\(\Rightarrow X:Clo\left(Cl\right)\)
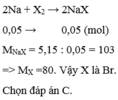
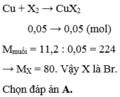
Gọi nguyên tố halogen đó là X
Các PTHH:
\(2Na+X_2-t^o\rightarrow2NaX\)
.....\(\dfrac{11,7}{2\left(23+X\right)}\)......\(\dfrac{11,7}{23+X}\).....(mol)
\(2Al+3X_2-t^o\rightarrow2AlX_3\)
....\(\dfrac{8,9.3}{2\left(27+3X\right)}\).....\(\dfrac{8,9}{27+3X}\).......(mol)
Ta có: \(\dfrac{11,7}{2\left(23+X\right)}=\dfrac{8,9.3}{2\left(27+3X\right)}\)
\(\Leftrightarrow\) X = 35,5 (Clo) \(\Rightarrow\) Halogen đó là clo