Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Viết phương trình hoá học của phản ứng giữa Fe với dung dịch H 2 SO 4 loãng.
Fe + H 2 SO 4 → FeSO 4 + H 2

Tìm số mol H2SO4 có trong dung dịch :
n H 2 SO 4 = n H 2 = 0,15 mol, tính ra C M H 2 SO 4 = 3M.

a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=n_{ZnCl_2}=n_{H_2}=0,15\left(mol\right)\)
b, mZn = 0,15.65 = 9,75 (g)
c, CM (H2SO4) = 0,15/0,05 = 3 M
d, mZnSO4 = 0,15.161 = 24,15 (g)
Bạn tham khảo nhé!

PTPU
Fe+ H2SO4\(\rightarrow\) FeSO4+ H2
0,15....0,15 \(\leftarrow\) 0,15 mol
ta có: nH2= \(\dfrac{3,36}{22,4}\)= 0,15( mol)
\(\Rightarrow\) mFe= 0,15. 56= 8,4( g)
CM H2SO4= \(\dfrac{0,15}{0,05}\)= 3M
Đổi: 50 ml = 0,05 l
a) PTHH: Fe + H2SO4 → FeSO4 + H2
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
b) Theo PT: \(n_{Fe}pư=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe}pư=0,15\times56=8,4\left(g\right)\)
c) Theo PT: \(n_{H_2SO_4}pư=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,15}{0,05}=3\left(M\right)\)

Tìm số mol Fe tham gia phản ứng :
n Fe = n H = 0,15 mol, suy ra m Fe = 8,4 gam.

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,3 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
c) \(n_{HCl}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
50ml = 0,05l
\(C_{M_{ddHCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
Chúc bạn học tốt

a) PTHH: Zn + H2SO4 -> ZnSO4 + H2
nH2= 0,15(mol)
=> nZn=nH2SO4=nZnSO4=nH2=0,15(mol)
b) mZn=0,15.65=9,75(g)
c) CMddH2SO4= 0,15/ 0,05=3(M)
d) mZnSO4= 161. 0,15=24,15(g)

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{3,36}{22,4}=0,15mol\)
a. PTHH: Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
TL: 1 1 1 1
mol: 0,15 \(\leftarrow\) 0,15 \(\leftarrow\) 0,15 \(\leftarrow\) 0,15
\(b.m_{Fe}=n.M=0,15.56=8,4g\)
Đổi 150ml = 0,15 l
\(c.C_{MddH_2SO_4}=\dfrac{n}{V}=\dfrac{0,15}{0,15}=1M\)
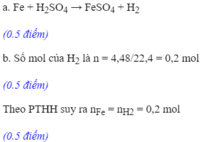

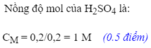
Đổi 50ml = 0,05 lít nha
CM=0,15 : 0,05 = 3 M