Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tìm số mol Fe tham gia phản ứng :
n Fe = n H = 0,15 mol, suy ra m Fe = 8,4 gam.

a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=n_{ZnCl_2}=n_{H_2}=0,15\left(mol\right)\)
b, mZn = 0,15.65 = 9,75 (g)
c, CM (H2SO4) = 0,15/0,05 = 3 M
d, mZnSO4 = 0,15.161 = 24,15 (g)
Bạn tham khảo nhé!

Viết phương trình hoá học của phản ứng giữa Fe với dung dịch H 2 SO 4 loãng.
Fe + H 2 SO 4 → FeSO 4 + H 2

PTPU
Fe+ H2SO4\(\rightarrow\) FeSO4+ H2
0,15....0,15 \(\leftarrow\) 0,15 mol
ta có: nH2= \(\dfrac{3,36}{22,4}\)= 0,15( mol)
\(\Rightarrow\) mFe= 0,15. 56= 8,4( g)
CM H2SO4= \(\dfrac{0,15}{0,05}\)= 3M
Đổi: 50 ml = 0,05 l
a) PTHH: Fe + H2SO4 → FeSO4 + H2
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
b) Theo PT: \(n_{Fe}pư=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe}pư=0,15\times56=8,4\left(g\right)\)
c) Theo PT: \(n_{H_2SO_4}pư=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,15}{0,05}=3\left(M\right)\)

a) PTHH: Zn + H2SO4 -> ZnSO4 + H2
nH2= 0,15(mol)
=> nZn=nH2SO4=nZnSO4=nH2=0,15(mol)
b) mZn=0,15.65=9,75(g)
c) CMddH2SO4= 0,15/ 0,05=3(M)
d) mZnSO4= 161. 0,15=24,15(g)

a) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
____0,15<--0,3<-------------0,15
=> mFe = 0,15.56 = 8,4 (g)
b) \(C_{M\left(ddHCl\right)}=\dfrac{0,3}{0,05}=6M\)

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,3 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
c) \(n_{HCl}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
50ml = 0,05l
\(C_{M_{ddHCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
Chúc bạn học tốt
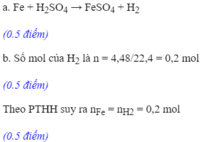

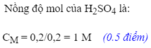
Tìm số mol H2SO4 có trong dung dịch :
n H 2 SO 4 = n H 2 = 0,15 mol, tính ra C M H 2 SO 4 = 3M.