Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g

Đặt hóa trị của M là x(x>0)
\(n_{O_2}=\dfrac{4,8}{32}=0,15(mol)\\ n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ a,PTHH:4M+xO_2\xrightarrow{t^o}2M_2O_x\\ 2M+2xHCl\to 2MCl_x+xH_2\\ \Rightarrow \Sigma n_{M}=\dfrac{0,6}{x}+\dfrac{0,3}{x}=\dfrac{0,9}{x}\\ \Rightarrow M_{M}=\dfrac{8,1}{\dfrac{0,9}{x}}=9x(g/mol)\\ \text {Thay }x=3 \Rightarrow M_{M}=27(g/mol)\\ \text {Vậy M là nhôm (Al)}\)
\(b,\text {Dung dịch B là }AlCl_3\\ n_{Al}=\dfrac{8,1}{27}=0,3(mol)\\ \Rightarrow n_{AlCl_3}=n_{Al}=0,3(mol)\\ n_{Al(OH)_3}=\dfrac{15,6}{78}=0,2(mol)\\ PTHH:3NaOH+AlCl_3\to Al(OH)_3\downarrow +3NaCl\\ \text {Vì }\dfrac{n_{AlCl_3}}{1}>\dfrac{n_{Al(OH)_3}}{1} \text {nên } AlCl_3 \text { dư}\\ \Rightarrow n_{NaOH}=3n_{Al(OH)_3}=0,6(mol)\\ \Rightarrow V_{dd_{NaOH}}=0,6.2=1,2(l)\)

D chứa 2 oxide: \(MgO,Fe_2O_3\) (oxide 2 kim loại có tính khử cao nhất)
Vậy hỗn hợp A dư, muối đồng(II) hết.
B gồm Cu, Fe
\(Mg+CuSO_4->MgSO_4+Cu\\ Fe+CuSO_4->MgSO_4+Cu\\ MgSO_4+2NaOH->Mg\left(OH\right)_2+Na_2SO_4\\FeSO_4+2NaOH->Fe\left(OH\right)_2+Na_2SO_4 \\ Mg\left(OH\right)_2-^{^{t^{^0}}}->MgO+H_2O\\2 Fe\left(OH\right)_2+\dfrac{1}{2}O_2-^{^{ }t^{^{ }0}}->Fe_2O_3+2H_2O\\ n_{Mg}=a;n_{Fe\left(pư\right)}=b\\ \Delta m\uparrow=9,2-6,8=40a+8b=2,4\left(I\right)\\ 40a+\dfrac{160b}{2}=6\left(II\right)\\ \Rightarrow a=b=0,05mol\\ m_B=9,2=64\left(a+b\right)+56n_{Fe\left(dư\right)}\\ n_{Fe\left(dư\right)}=0,05\left(mol\right)\\ \%m_{Mg}=\dfrac{24.0,05}{6,8}.100\%=17,65\%\\ \%m_{Fe}=82,35\%\)
Bước 1: Viết các phương trình phản ứng
Phản ứng 1: Mg + CuSO4 -> MgSO4 + Cu
Phản ứng 2: Fe + CuSO4 -> FeSO4 + Cu
Phản ứng 3: Cu(OH)2 -> CuO + H2O
Bước 2: Tính toán số mol của chất rắn B
Khối lượng chất rắn B = 9,2g
Khối lượng mol CuSO4 = 63.55g/mol + 32.07g/mol + (4 * 16g/mol) = 159.62g/mol
Số mol CuSO4 = 9,2g / 159.62g/mol = 0.0577 mol
Vì phản ứng 1 và phản ứng 2 xảy ra hoàn toàn, nên số mol Mg và Fe trong hỗn hợp A cần tìm là 0.0577 mol.
Bước 3: Tính toán % số mol mỗi kim loại trong A
Khối lượng mol Mg = 24.31g/mol
Khối lượng mol Fe = 55.85g/mol
% số mol Mg trong A = (0.0577 mol * 24.31g/mol) / 6.8g * 100% = 20.34%
% số mol Fe trong A = (0.0577 mol * 55.85g/mol) / 6.8g * 100% = 47.28%
Vậy, % số mol mỗi kim loại trong hỗn hợp A là: Mg: 20.34% và Fe: 47.28%.

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
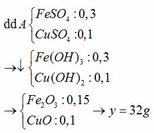

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+





M g + C u C l 2 → M g C l 2 + C u
M g + Z n C l 2 → M g C l 2 + Z n
Theo bài ta suy ra: Mg tan hết, C u C l 2 phản ứng hết, Z n C l 2 còn dư.
⇒ m C u = m E k h ô n g tan = 1,28g
⇒ n C u = 1,28/64 = 0,02 mol
⇒ m Z n = m D - m C u
= 1,93 - 1,28 = 0,65g
⇒ n Z n = 0,65/65 = 0,01 mol
⇒ n M g = n Z n + n C u = 0,03 mol
⇒ m M g = 0,03.24=0,72g
⇒ Chọn D.