Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g

Ta có số mol e kim loại nhường là (19,7 - m)/8 + 0,8
Ta có số mol e nhận tạo khi SO2 là (19,7 -m)/8 + 0,8 => Số mol SO2 là (29,7 - m)/16 + 0,4
Trong phản ӭng với H2SO4 đặc, ta có số mol H2SO4 = số mol H2O = 2 số mol SO2
Áp dụng bảo toàn khối lượng => m = 26,5
=> Đap an C

Đáp án D.
Có n F e = n H 2 = 4 , 48 22 , 4 = 0 , 2 m o l n C u = n S O 2 = 8 , 96 22 , 4 = 0 , 4 m o l ⇒ m = 56 . 0 , 2 + 64 . 0 , 4 = 36 , 8 g a m
gần nhất với giá trị 36,82
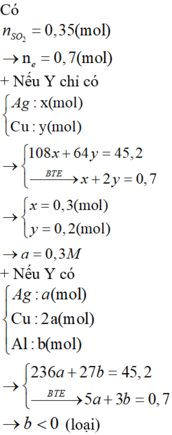
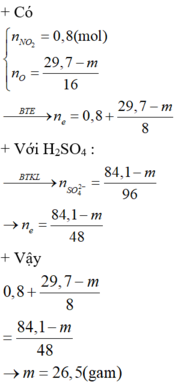
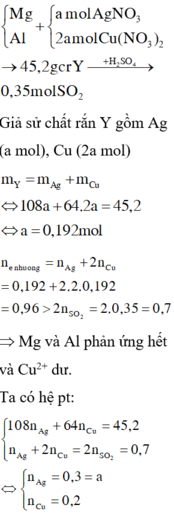
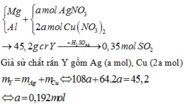
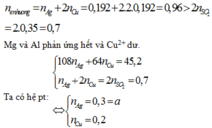
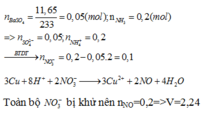
Đáp án A
Bảo toàn e : 2nCu = 2nSO2 = 2.0,15
=> mCu = 9,6g
=>A