Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCuO=0,02 mol
CuO+H2=>H2O+Cu
Bđ0,02 mol
Pứ:x mol =>x mol
Dư:0,02-x mol
Cr sau pứ gồm Cu và CuO
=>64(0,02-x)+80x=1,344
=>16x=0,064=>x=0,004
H%=0,004/0,02.100%=20%

Gọi x là số mol CuO tham gia pư
ylà số mol CuO dư
CuO+H2----->Cu+H2O
Ta có hệ PT:
(x+y)80=28
64x+80y=24
⇒⇒ x=0,25;y=0,1
mH2O=0,25*18=4,5g
Đề bài yêu cầu là tìm \(H\) phản ứng chứ ko phải là \(m_{hơi.nước}\)

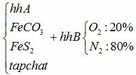
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
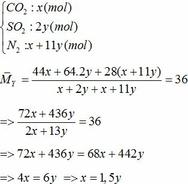
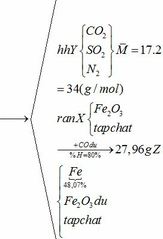
Khối lượng Fe có trong Z là:
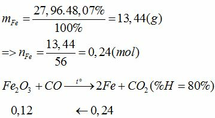
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
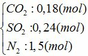
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
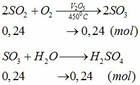
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)

Dẫn từ từ một luồng khí cacbon monoxit đi qua ống sứ chứa 50 g bột CuO ở nhiệt độ cao . Sau phản ứng kết thúc , thu được a gam chất rắn và V lít khí ( đktc ) . Sục toàn bộ lượng khí thoát ra vào đ Ca(OH)2 dư , thu được 50 gam chất kết tủa .
a ) Tính a .
b ) Tính thể tích khí bay lên ( đktc ) khi hòa tan a gam chất rắn trên vào dd H2SO4đặc nóng . Biết các phản ứng xảy ra hoàn toàn và hiệu suất phản ứng đạt 100% .
BÀI LÀM
a ) nCuO = \(\dfrac{50}{80}=0,625\left(mol\right)\) ; mchất kết tủa = \(n_{CaCO_3}=\dfrac{50}{100}=0,5\left(mol\right)\)
Ta có phương trình phản ứng : \(CuO+CO\rightarrow Cu+CO_2\)
Theo phương trình phản ứng : 1 mol................1mol...1 mol
Theo bài ra :......................0,625 mol..........0,625 mol...0,625 mol
\(\Rightarrow\) Chất rắn sau phản ứng là Cu , chất khí sau phản ứng là CO2 .
\(\Rightarrow\) mCu = 0,625 . 64 = 40 ( gam )
\(\Rightarrow\) \(V_{CO_2}=\) 0,625 . 22,4 = 14 ( lít )
Vậy a = 40 gam .
b )Ta có phương trình phản ứng : \(Cu+2H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
Theo phương trình phản ứng :......1 mol.......................................1 mol
Theo bài ra : .............................0,625 mol.................................0,625 mol
\(\Rightarrow\) \(V_{SO_2}=0,625.22,4=14\left(lit\right)\)
Suy ra thể tích của khí thoát ra ( đktc ) là : \(V_{CO_2}+V_{SO_2}=14+14=28\left(lit\right)\)
Vậy V = 28 lít .
#Nguồn_làm_bừa ^ . ^
Hướng dẫn cách làm nhé !
Tính số mol của CuO : nCuO = \(\dfrac{50}{80}=?\) (mol) ; m(kết tủa) = mCaCO3 = 50 (g) => nCaCO3 = \(\dfrac{50}{100}=?\)
Viết PTHH 1 :
\(CuO+CO-^{t0}->Cu+CO2\)
? mol............................? mol.....? mol
Chất rắn thu được là Cu và khí thu được là CO2
a) Tìm được nCu thì => mCu = ?
b) Viết PTHH 2 và 3 ra :
Thể tích khí ở đây bao gồm Thể tích của Co2 ; và Thể tích khí SO2 ( bởi vì đề chưa cho tính VCO2 ở câu a )
nCO2 = nCO2(1) + nCO2(2) = ?
nSO2 tính theo nCu

CuO + CO => (to) Cu + CO2
nCuO = m/M = 15/80 = 0.1875 (mol)
Theo pt ==> nCu lý thuyết = 0.1875 (mol)
==> mCu lý thuyết = n.M = 0.1875x64 = 12 (g)
H% = mthực tếx100/mlý thuyết = 9.4 x 100/12 = 78.3(3) %
PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
a) Hiện tượng: Xuất hiện chất rắn màu đỏ
b) Ta có: \(n_{CuO}=\frac{20}{80}=0,25\left(mol\right)\) \(\Rightarrow n_{Cu}=0,25mol\) \(\Rightarrow m_{Cu}=0,25\cdot64=16\left(g\right)\)
\(\Rightarrow H\%=\frac{16}{16,8}\cdot100\approx95,24\%\)
c) Theo PTHH: \(n_{H_2}=n_{CuO}=0,25mol\)
\(\Rightarrow V_{H_2}=0,25\cdot22,4=5,6\left(l\right)\)