Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì Cu không tác dụng với HCl nên ta có chất rắn không tan là Cu
\(Theo-\text{đ}\text{ề}-b\text{ài}-ta-c\text{ó}:\) nCuO = \(\dfrac{12}{80}=0,15\left(mol\right)\) ; nCu= \(\dfrac{6,6}{64}\approx0,103\left(mol\right)\)
Ta có PTHH :
CuO + H2\(-^{t0}\rightarrow Cu+H2O\)
Theo PTHH ta có :
\(nCuO=\dfrac{0,15}{1}mol>nCu=\dfrac{0,103}{1}mol\) nên => nCuO dư ; nCu hết
Ta có :
\(H=\dfrac{\left(s\text{ố}-mol-ch\text{ất}-thi\text{ếu}\right)}{\left(s\text{ố}-mol-ch\text{ất}-d\text{ư}\right)}.100\%=\dfrac{0,103}{0,15}.100\%\approx68,67\%\)
Vậy ...............

P1: Gọi số mol CO, H2 trong phần 1 là a, b mol
PTHH: CuO + CO --to--> Cu + CO2
CuO + H2 --to--> Cu + H2O
\(n_{Cu}=\dfrac{4,48}{64}=0,07\left(mol\right)\)
=> a + b = 0,07 (1)
P2: Gọi số mol CO, H2 trong phần 2 là ak, bk mol
=> 28ak + 2bk - 28a - 2b = 1,32 (2)
\(n_{CaCO_3}=\dfrac{6}{100}=0,06\left(mol\right)\)
PTHH: CO + O2 --to--> CO2
CO2 + Ca(OH)2 --> CaCO3 + H2O
=> ak = 0,06 (mol) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,02\\b=0,05\\k=3\end{matrix}\right.\)
=> m = (0,02.28 + 0,05.2) + (0,06.28+0,15.2) = 2,64(g)
\(\left\{{}\begin{matrix}\%CO=\dfrac{0,02}{0,07}.100\%=28,57\%\\\%H_2=\dfrac{0,05}{0,07}.100\%=71,43\%\end{matrix}\right.\)

nCuO=0,02 mol
CuO+H2=>H2O+Cu
Bđ0,02 mol
Pứ:x mol =>x mol
Dư:0,02-x mol
Cr sau pứ gồm Cu và CuO
=>64(0,02-x)+80x=1,344
=>16x=0,064=>x=0,004
H%=0,004/0,02.100%=20%

2H(Axit) + O(Oxit) → H2O
→ nH(Axit) = 2.nO(Oxit)
Gọi số mol của Fe3O4 và CuO lần lượt là x và y
BTNT O: 4x + y = 0,6
BTKL: 56 . 3x + 64y = 29,6
=> x = 0,1 và y = 0,2
=> %Fe3O4 = 59,18%
%CuO = 40,82%

\(n_{FeO\left(bđ\right)}=a\left(mol\right);n_{CuO\left(bđ\right)}=y\left(mol\right)\\ n_{Cu}=\dfrac{0,64}{64}=0,01\left(mol\right)\)
\(\Rightarrow72a+80y=2,28\left(1\right)\)
\(PTHH:\\ FeO+H_2\underrightarrow{t^o}Fe+H_2O\\CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Vì phản 1 thời gian (phản ứng không hoàn toàn) nên sau phản ứng còn FeO, CuO dư. Vậy 1,96g hỗn hợp rắn thu được gồm Fe: x (mol); Cu: 0,01(mol); FeO dư: a - x (mol); CuO dư: y - 0,01 (mol)
Ta có phương trình:
\(56x+0,64+72\left(a-x\right)+80\left(y-0,01\right)=1,96\\ 72a+80y-16x=1,8\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow2,28-16x=1,8\Leftrightarrow x=0,03\left(mol\right)\)
\(\Rightarrow m=m_{Fe}+m_{Cu}=56.0,03+0,64=2,32\left(g\right)\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)
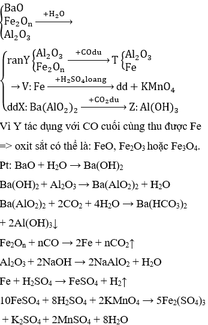
CuO + H2 to-----> Cu + H2O
0,15----> 0,15-------->0,15
nCuO=m/M=12/80= 0,15 (mol)
mCuO=M.n=64.0,15=9,6(g)
HCuO=(mcupư/mcudư).100%=(6,6/9,6).100%=68.75%