Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

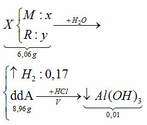
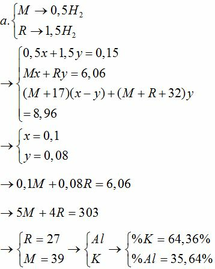
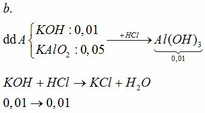
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

Câu 1
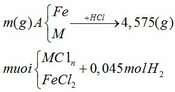
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
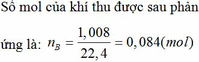
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
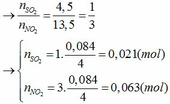
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
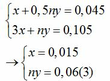
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.


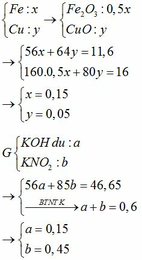
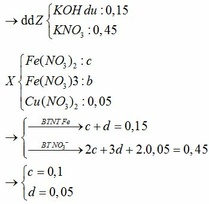

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

- Gọi X, Y lần lượt là kim loại hóa trị II và III
X+2HCl\(\rightarrow\)XCl2+H2(1)
2Y+6HCl\(\rightarrow\)2YCl3+3H2(2)
Câu a:
- Phần B1: 2H2+O2\(\rightarrow\)2H2O
\(n_{H_2}=n_{H_2O}=\dfrac{4,5}{18}=0,25mol\)\(\rightarrow\)\(n_{H_2\left(B\right)}=2.0,25=0,5mol\)
Theo PTHH 1+2 ta có: \(n_{HCl}=2n_{H_2}=2.0,5=1mol\)
bảo toàn khối lượng:18,4+1.36,5=mmuối khan+0,5.2
mmuối khan=53,9 gam
Câu b:
H2+Cl2\(\rightarrow\)2HCl
HCl+NaOH\(\rightarrow\)NaCl+H2O
\(n_{HCl}=2n_{H_2}=2.0,25=0,5mol\)
\(n_{NaOH}=\dfrac{200.1,2.20}{40.100}=1,2mol\)
Dựa theo tỉ lệ mol có trong PTHH ta thấy NaOH dư=1,2-0,5=0,7 mol
nNaCl=nHCl=0,5mol
mdd=0,5.36,5+200.1,2=258,25g
\(C\%_{NaOH}=\dfrac{0,7.40.100}{258,25}\approx10,84\%\)
\(C\%_{NaCl}\dfrac{0,5.58,5.100}{258,25}\approx11,33\%\)

2Na+2H2O=>2NaOH+H2
a a 1/2a
2K+2H2O=>2KOH+H2
b b 1/2b
NaOH+HCL=>NaCl+H2O
a a
KOH+HCl=>KCL+H2O
b b
theo bài ra:
1/2(a+b)=2,24/22,4=0,1 mol
58,5a+74,5b=13,2
=> a=0,10625 mol
b=0,09375 mol
=> m Na=2,44375
m K=3,65625
b) 2H2+O2=>2H2O
nH2=0,1 mol
theo pt: nO2=1/2nH2=0,05mol
=> VO2 =0,05*22,4=1,12 lít

sửa đề: Tính V và a
\(a.n_{H_2}=\dfrac{3,7185}{24,79}=0,15mol\\ n_{Mg}=a;n_{Fe}=b\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \Rightarrow\left\{{}\begin{matrix}a+b=0,15\\24a+56b=6,8\end{matrix}\right.\\ \Rightarrow a=0,05;b=0,1\\ \%m_{Mg}=\dfrac{0,05.24}{6,8}\cdot100=17,65\%\\ \%m_{Fe}=100-17,65=82,35\%\)
\(b.Mg+2H_2SO_4\rightarrow MgSO_4+SO_2+2H_2O\\ Fe+2H_2SO_4\rightarrow FeSO_4+SO_2+2H_2O\\ n_{SO_2}=0,05+0,1=0,15mol\\ V_{SO_2}=0,15.24,79=3,7185l\\ n_{H_2SO_4\left(a\right)}=0,05+0,1=0,15mol\\ C_{M\left(H_2SO_4\right)}=\dfrac{0,15}{0,3}=0,5M\)

Để giải bài toán này, ta cần sử dụng các phương trình hoá học và các phương trình tính toán liên quan đến phản ứng hóa học. Dưới đây là cách giải chi tiết:
a. Đầu tiên, ta cần xác định số mol của Mg và Fe trong hỗn hợp X. Ta biểu diễn số mol của Mg là nMg và số mol của Fe là nFe.
Ta có phương trình phản ứng như sau: Mg + H2SO4 → MgSO4 + H2↑ Fe + H2SO4 → FeSO4 + H2↑
Với 6,8 (gam) hỗn hợp X, ta cần tính số mol của hỗn hợp X bằng cách chia khối lượng cho khối lượng mol của hỗn hợp X.
Khối lượng mol của Mg là 24,3 g/mol, khối lượng mol của Fe là 55,8 g/mol. Vậy, khối lượng mol của hỗn hợp X là: (6,8 g) / (24,3 g/mol + 55,8 g/mol) = 0,0677 mol
Tiếp theo, ta cần tính nồng độ của dung dịch H2SO4 (a). Để làm điều này, ta sử dụng công thức:
nH2SO4 = V × a
Trong đó, nH2SO4 là số mol H2SO4, V là thể tích dung dịch H2SO4 (300 ml = 0,3 l), và a là nồng độ của dung dịch H2SO4.
Ta biết rằng số mol H2SO4 phản ứng là nH2SO4 = 0,0677 mol (do số mol của Mg và Fe trong hỗn hợp X là như nhau). Vì vậy, ta có:
0,0677 mol = 0,3 l × a a = 0,0677 mol / 0,3 l a = 0,2257 M
Tiếp theo, ta tính khối lượng của muối có trong dung dịch tạo thành sau phản ứng. Ta biết rằng phản ứng xảy ra theo tỉ lệ 1:1 giữa Mg và muối MgSO4, và tỉ lệ 1:1 giữa Fe và muối FeSO4. Vì vậy, số mol của muối MgSO4 và muối FeSO4 sẽ bằng số mol ban đầu của Mg và Fe trong hỗn hợp X.
Khối lượng muối MgSO4 và muối FeSO4 có thể tính bằng công thức:
Khối lượng muối = số mol × khối lượng mol
Khối lượng muối MgSO4 = nMg × khối lượng mol MgSO4 Khối lượng muối FeSO4 = nFe × khối lượng mol FeSO4
Khối lượng mol MgSO4 là 120,4 g/mol và khối lượng mol FeSO4 là 151,9 g/mol.
Vậy, khối lượng muối có trong dung dịch tạo thành là: Khối lượng muối = (nMg + nFe) × khối lượng mol muối Khối lượng muối = 0,0677 mol × (120,4 g/mol + 151,9 g/mol) = 18,69 g
Cuối cùng, ta tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp X:
Phần trăm khối lượng Mg = (nMg × khối lượng mol Mg) / khối lượng hỗn hợp X × 100% Phần trăm khối lượng Fe = (nFe × khối lượng mol Fe) / khối lượng hỗn hợp X × 100%
Phần trăm khối lượng Mg = (0,0677 mol × 24,3 g/mol) / 6,8 g × 100% Phần trăm khối lượng Fe = (0,0677 mol × 55,8 g/mol) / 6,8 g × 100%
b. Nếu cho hỗn hợp X tác dụng vừa đủ với H2SO4 đặc nóng, phản ứng sẽ xảy ra theo phương trình:
Mg + H2SO4 → MgSO4 + H2↑
Từ phương trình này, ta thấy tỉ lệ giữa số mol Mg và số mol H2SO4 là 1:1. Vì vậy, số mol H2SO4 tham gia phản ứng sẽ bằng số mol Mg trong hỗn hợp X. Ta đã tính được số mol Mg trong hỗn hợp X là 0,0677 mol.
Vậy, khối lượng H2SO4 tham gia phản ứng là: Khối lượng H2SO4 = số mol H2SO4 × khối lượng mol H2SO4
Khối lượng mol H2SO4 là 98 g/mol.
Vậy, khối lượng H2SO4 tham gia phản ứng là: Khối lượng H2SO4 = 0,0677 mol × 98 g/mol = 6,63 g
Để tính giá trị của V, ta sử dụng công thức:
V = số mol khí SO2 × (R × T) / P
Trong đó, số mol khí SO2 là số mol Mg trong hỗn hợp X (0,0677 mol), R là hằng số khí (0,0821 L·atm/(mol·K)), T là nhiệt độ (25 °C = 298 K), và P là áp suất (1 bar).
V = 0,0677 mol × (0,0821 L·atm/(mol·K) × 298 K) / 1 bar V = 1,61 L
Vậy, giá trị của V là 1,61 L và khối lượng H2SO4 tham gia phản ứng là 6,63 g.



Gọi số mol của Ba và K lần lượt là x và y
\(PTHH_1:Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)
(mol) 1 2 1 1
(mol) x 2x x x
\(PTHH_2:K+H_2O\rightarrow KOH+\frac{1}{2}H_2\uparrow\)
(mol) 1 1 1 \(\frac{1}{2}\)
(mol) y y y \(\frac{1}{2}y\)
Từ PT (1) và (2) ta có hpt:
\(\left\{{}\begin{matrix}137x+39y=3,52\\171x+56y=4,54\end{matrix}\right.\Leftrightarrow x=y=\frac{1}{50}\left(mol\right)\)
Khối lượng của Ba là:
\(m_{Ba}=n.M=\frac{1}{50}.137=2,74\left(g\right)\)
\(\rightarrow\%m_{Ba}=\frac{2,74.100\%}{3,52}\approx77,8\left(\%\right)\)
Khối lượng của K là:
\(m_K=n.M=\frac{1}{50}.39=0,78\left(g\right)\)
\(\rightarrow\%m_K=100\%-77,8\%\approx22,2\left(\%\right)\)
Câu 2 không hiểu lắm nên không làm :)