Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Các phương trình phản ứng
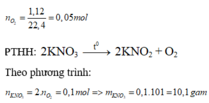
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.

2KClO3\(\overset{t^0}{\rightarrow}2KCl+3O_2\)
2KNO3\(\overset{t^0}{\rightarrow}2KNO_2+O_2\)
b) Nếu dùng 0,1 mol mỗi chất thì:
+ Số mol O2 ở trường hợp 1 là 0,1.3:2=0,15mol
+Số mol O2 ở trường hợp 2 là; 0,1.1:2=0,05mol
c)Số mol O2=1,12:22,4=0,05mol
- Số mol KClO3=0,05.2:3\(\approx0,33mol\)
\(m_{KClO_3}=0,33.122,5=40,425g\)
Số mol KNO3=0,05.2=0,1 mol
\(m_{KNO_3}=0,1.101=10,1g\)
a) Các phương trình phản ứng phân hủy:
2KNO3 → 2KNO2 + O2 ↑ (1)
2KClO3 → 2KCl + 3O2 ↑ (2)
b) Theo phương trình (1) và (2): số mol hai muối tham gia phản ứng nhu nhau (0,1 mol), nhưng số mol oxi sinh ra không như nhau.
Theo phương trình (1): nO2 = 1/2 nKNO3 = 0,05 mol
VO2 = 1,12 lít
Theo phương trình (2): nO2 = 3/2 nKClO3 = 0,15 mol
VO2 = 0,15 .22,4 = 3,36 lít.
c) nO2 = 1,12 /22,4 =0,05 mol;
MKNO3 = 101; MKClO3 = 122,5
2KNO3 → 2KNO2 + O2
2KClO3 → 2KCl + 3O2
nKNO3 = 0,05 . 2 = 0,1 mol.
mKNO3 cần dùng = 0,1 x 101 = 10,1g
mKClO3 cần dùng = 2 x 0,05 /3 x 122,5 = 4,08g.

nFe3O4 = \(\dfrac{2,32}{232}=0,01\) mol
Pt: 3Fe + ...2O2 --to--> Fe3O4
0,03 mol<-0,02 mol<--0,01 mol
mFe cần dùng = 0,03 . 56 = 1,68 (g)
VO2 cần dùng = 0,02 . 22,4 = 0,448 (lít)
Pt: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
...0,04 mol<---------------------------------0,02 mol
mKMnO4 cần dùng = 0,04 . 158 = 6,32 (g)
a) Theo đề bài ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
PTHH: \(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
0,03mol..........0,02mol.....0,01mol
\(\Rightarrow\left\{{}\begin{matrix}V_{O_2\left(đktc\right)}=0,02.22,4=0,448\left(l\right)\\V_{O_2\left(đktc\right)}=0,2.22=0,48\left(l\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
b) PTHH:
\(2KMnO_4\underrightarrow{t^0}K2MnO_4+MnO_4+O_2\uparrow\)
0,04mol.................................0,02mol
\(\Rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)
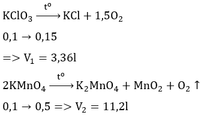

Không có CTHH cụ thể cho sự phân hủy của muối nhé, có nhiều loại phân hủy muối.
Công thức chung thì không có nhưng tùy ĐK thì có:
VD: muối gốc SO4 không bị nhiệt phân
Muối gốc CO3 nhiệt phân ra oxit + CO2 ( trừ muối tan)
...