Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(m_{Fe}\) + \(m_{Cu}\) = 29,6
hay\(m_{Cu}\) +4 + \(m_{Cu}\) = 29,6
2\(m_{Cu}\) = 25,6
\(m_{Cu}\) =12,8(g)
=> \(m_{Fe}\) = 16,8(g)
Số mol của 12,8 g Cu:
\(\frac{12,8}{64}\)= 0,2(mol)
Số mol của 16,8g Fe:
\(\frac{16,8}{56}\)=0,3(mol)
CO + CuO \(\rightarrow\) Cu + C\(O_2\)
1(mol) 1(mol)
0,2(mol) 0,2(mol)
4CO + \(Fe_3\)\(O_4\) \(\rightarrow\) 3Fe + 4C \(O_2\)
4(mol) 3(mol)
0,4(mol) 0,3(mol)
Thể tích CO cần dùng:
(0,2+0,4).22,4= 13,44(l)
PTHH: Fe3O4+4Co->3Fe+4Co2 (1)
CuO+Co->Cu+Co2 (2)
Lại có: mFe+mCu=29,6
mFe-mCu=4
=>mFe=16,8=> nFe=0.3mol
mCu=12,8g=>nCu=0.2mol
Theo PTHH(1)
nFe:nCo= 3:4=> nCo=0,3.4/3=0,4mol
nCu:nCo= 1:1 => nCo= 0,2mol
=> nCo=0,6mol=13,44(l)

Gọi số mol Cuo và Fe2O3 lần lượt là a,b
CuO + H2 = Cu + H2O
a a a (mol)
Fe2O3 + 3H2 = 2Fe +3H2O
b 3b 2b (mol)
Ta có hệ phương trình: 80a +160b= 40
64a + 112b= 29,6
=> a= 0,2 (mol) ; b= 0,15 (mol)
Số mol H2 phản ứng : 0,2 + 3 x 0,15= 0,65 (mol)
Số mol H2 đã dùng là: 0,65 : 75 x 100= 0,8 (mol)
Thể tích H2 là 0,8 x 22,4= 17,92 (L)
Khối lượng cu trong hỗn hợp là: 0,2 X 64 = 12,8 (g)
%mCu= 12,8 : 29,6 X 100= 43,2%
%mFe= 100%- 43,2%= 56,8%
có mấy cái gần bằng nha bạn, mình không chắc đúng k thử tham khảo nha

PTHH của các phản ứng:
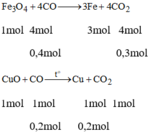
Gọi x là khối lượng của Cu sau phản ứng
→ Khối lượng của sắt sau phản ứng là x+4
Theo đề bài ta có: x + x + 4 = 29,6 → x = 12,8(g)
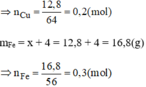
Theo pt: 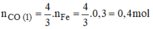
n C O ( 2 ) = n C u = 0 , 2 m o l
n C O = (0,4 + 0,2).22,4 = 13,44(l)

CuO + H2 \(\rightarrow\) Cu + H2O (1)
Fe2O3 + 3H2 \(\rightarrow\) 2Fe + 3H2O (2)
gọi mCuO =a (g) => mFe2O3 = 3a (g)
mà mCuO + mFe2O3 =24(g)
=> a + 3a = 24
=> 4a=24 => a =6
=> mCuO = 6(g) và mFe2O3 = 18(g)
=> nCuO = m/M = 6/80=0,075(mol) và nFe2O3 = m/M = 18/160=0,1125(g)
Theo PT(1) => nCu = nCuO = 0,075(mol)
=> mCu = n .M = 0,075 x 64=4,8(g)
TheoPT(2) => nFe = 2 .nFe2O3 = 2 x 0,1125 =0,225(mol)
=> mFe = n .M = 0,225 x 56 =12,6(g)

a) PTHH : \(X_2O_3+3CO \rightarrow 2X+3CO_2\)
\(n_{CO_2}=0,15 (mol)\)\(\rightarrow n_{O(oxit)}=0,15 (mol)\)
\(m=m_{hh}-m_{O}=10,8-0,15.16=8,4 (g)\)
b) Gọi a là số mol của X và \(X_2O_3\)
\(aX+a(2X+16.3)=10,8\) \(\rightarrow 3aX+48a=10,8\) (*)
\(n_{X_2O_3}=0,05 (mol) \rightarrow a=0,05 (mol)\)
Thay \(a=0,05 (mol)\) vào (*) ta được : \(0,15X+48.0,05=10,8 \rightarrow X=56\) ( Vô lý )
Vậy X là Fe và \(X_2O_3\) là \(Fe_2O_3\)

H2 + CuO \(\rightarrow\) Cu + H2O (1)
Fe2O3 + 3H2 \(\rightarrow\) 2Fe + 3H2O (2)
Có : mFe2O3 : mCuO = 3 : 1
=> mFe2O3 = 3. mCuO
mà mFe2O3 + mCuO = 24(g) => 3.mCuO + mCuO = 24
=> mCuO = 6 (g) => nCuO = m/M = 6/80 =0,075(mol)
=> mFe2O3 = 24-6 =18(g) => nFe2O3 = m/M = 18/160 =0,1125(mol)
Theo PT(1) => nCu = nCuO = 0,075(mol)
=> mCu = n .M = 0,075 x 56 = 4,2(g)
Theo PT(2) => nFe = 2. nFe2O3 = 2 x 0,1125 = 0,225(mol)
=> mFe = n .M = 0,225 x 56 =12,6(g)

Bài 2:
Gọi x,y lần lượt là số mol của Fe2O3, CuO
Pt: Fe2O3 + 3CO --to--> 2Fe + 3CO2
.......x................................2x
.....CuO + CO --to--> Cu + CO2
.......y............................y
Ta có hệ pt: \(\left\{{}\begin{matrix}160x+80y=24\\112x+64y=17,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
P/s: tới đây tương tự bài 1, nếu bn ko hỉu thì nt hỏi mình nhé
\(CO\left(x\right)+CuO\left(x\right)\rightarrow Cu\left(x\right)+CO_2\)
\(3CO\left(3y\right)+Fe_2O_3\left(y\right)\rightarrow3CO_2+2Fe\left(2y\right)\)
Gọi số mol của CuO và Fe2O3 lần lược là x, y thì ta có:
\(\left\{\begin{matrix}64x+56y=29,6\\56y-64x=4\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
\(\Rightarrow n_{CO}=0,2+3.0,3=1,1\)
\(\Rightarrow V_{CO}=1,1.22,4=24,64\)