

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án D
2 kim loại sau phản ứng là Cu và Al => Mg hết, CuSO4 hết, Al2(SO4)3 dư
=> nCu=nCuSO4=0,3 mol => mAl=21,9-0,3.64=2,7 gam =>nAl=0,1 mol
Mg + Cu2+ → Mg2+ + Cu
0,3 ← 0,3
3Mg + 2Al3+ → 3Mg2+ + 2Al
0,15 ← 0,1
=>mMg = 0,45.24 = 10,8 gam

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam


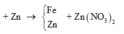
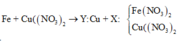
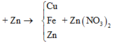
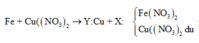
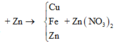
Theo định luật bảo toàn khối lượng, ta có:

![]()
![]()
tìm được m = 4,48 (g)
Đáp án A

\(n_{Ag+}=0,036mol, n_{Cu2+}=0,024mol\)
Khối lượng Cu, Ag sinh ra tối đa là 0,036.108+0,024.64=5,424(g) > 4,21 gam
Suy ra hh A tan hết vào trong dung dịch, 4,21g rắn X sinh ra chỉ gồm Ag và có thể có Cu.
Lượng Ag sinh ra tối đa là 0,036.108=3,888 (g) <4,21 gam
suy ra rắn X có 3,888 gam Ag và 4,21-3,888=0,322 gam Cu
Lượng Cu2+ còn lại trong dung dịch Y là 0,024.64-0,322=1,214(g)
Bảo toàn điện tích, ta thấy dd Y có số mol điện dương là \(n_{\left(+\right)ddY}=n_{NO3-}=1.n_{Ag}+2.n_{Cu2+}=0,036+0,024.2=0,084\left(mol\right)\)
Trong khi đó lại cho tới 0,08 mol Mg vào dd Y, nên chắc chắn Mg sẽ dư. suy ra rắn Z gồm toàn bộ m gam hỗn hợp A ban đầu, Cu và Mg dư
\(m_{Mg dư}=24\left(0,08-\frac{0,084}{2}\right)=0,912\left(g\right)\)
Vậy \(m=m_Z-m_{Cu}-m_{Mg dư}=4,826-0,912-1,214=2,7\left(g\right)\)