Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có n O = 3n Al2O3 = 86,3. 19,46697567 /(100.16)= 1,05 mol
=>nAl2O3 =0,35 mol
Khi phản ứng với nước ta có dạng tổng quát: M + xH2O → M(OH)x + 0,5x H2
=> n OH =2 n H2 = 0,6 mol.2 = 1,2 mol
Al2O3 + 2OH- → 2AlO2- + 2H2O
=> Sau phản ứng thì n OH dư = 0,5 mol và n AlO2- = 0,7 mol
Khi cho 2,4 mol HCl thì
H+ + OH- → H2O
H+ +AlO2- + H2O → Al(OH)3
Al(OH)3 + 3 H+ → Al3+ + 3H2O
=> n Al(OH)3 =0,3 mol => m=0,3.78 = 23,4g
=>C

Đáp án A
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa:
nAlO2– = nAl/Al2O3 = 0,7 mol
& nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa:
nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – 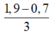 = 0,3 mol
= 0,3 mol
+ Cho 0,3 mol Al(OH)3 phản ứng
với KOH ta có phản ứng:
Al(OH)3 + KOH → KAlO2 + 2H2O
⇒ nKOHcần dùng = 0,3.
⇒ VKOH = 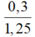 = 0,24 lít = 240 ml
= 0,24 lít = 240 ml


| GIẢI THÍCH THÊM |
| Số mol điện tích dương n+ mà tôi gọi trong lời giải thích là điện tích dương ứng với Na, K, Ba ta suy ra từ số mol H2. |

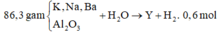



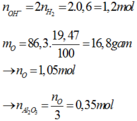
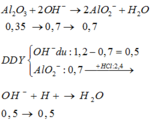
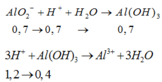
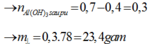
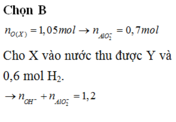


bài này em tìm được lỗi sai của mình r thầy ạ. thầy k cần phải chữa đâu ạ. :d