Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C.
Dung dịch Y chứa H+ với n H + = 2 n H 2 = 0 , 12 mol ⇒ H + ban đầu: 0 , 12 + 2 n H 2 ⇒ n O 2 = 0 , 03 + 0 , 5 n H 2
Khối lượng dung dịch giảm:
m Cu + m khí = 300 - 283 , 32 = 16 , 68 ⇒ 64 n Cu + 71 n Cl 2 + 18 n H 2 = 15 , 72 (1)
→ BT : e 2 n Cu = 0 , 12 + 2 n Cl 2 (2) và
160 n Cu + 117 n Cl 2 = 31 , 76 (3)
Từ (1), (2), (3) suy ra:
n Cu = 0 , 14 mol ; n Cl 2 = 0 , 08 mol ; n H 2 = 0 , 06 mol ⇒ n O 2 = 0 , 06 mol
Vậy V = 3,136 lít.

Đáp án C
n N a C l = 0,18 mol
Điện phân dung dịch X sau một thơi gian thấy giảm 18,65 gam
Cho Fe vào dung dịch thu được 0,035 mol NO do vậy dung dịch có H+. Do đó Cl- bị điện phân hết trước Cu2+.
Ta có:
![]()
(do Fe dư).
Lượng Fe bị ăn mòn do phản ứng này là chính bằng khối lượng thanh Fe giảm.
Do vậy Cu2+ bị điện phân hết
Ta có:
![]()
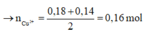
Vậy m H 2 O d p = 18,65 - 0,16.64 - 0,09.71 - 0,035.32 = 0,9 g

Chọn A.
Khi cho Fe tác dụng với Y thì hỗn hợp rắn gồm Cu và Fe dư.
với nFe pư =
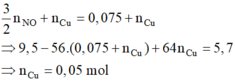
và n H + = 4 n NO = 0 , 2 mol . Dung dịch Y gồm Cu2+ (0,05); H+ (0,2); Na+ (0,5V) và NO3- (2V)
→ BTDT V = 0,2. Dung dịch ban đầu gồm Cu(NO3)2 (0,2 mol) và NaCl (0,1 mol)
Khối lượng dung dịch giảm: m = 64.(0,2 - 0,05) + 71.0,05 + 32.0,05 = 14,75 (g)

Đáp án D
Do 2x<y nên ta có các phương trình điện phân như sau:
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
2H2O + 2NaCl → 2NaOH + Cl2 + H2 (nNaOH = nH2/1,5 = 0,15/1,5 = 0,1 mol)
2H2O → 2H2 + O2
Dung dịch Y: NaOH và Na2SO4
Sau khi cho Al dư vào thu được nNaAlO2 = nNa2SO4 = nH2/1,5 = 0,1 mol
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
0,1 0,2 0,1 0,1 ←0,1
(2) 2H2O + 2NaCl → 2NaOH + Cl2 + H2 (nNaOH = nH2/1,5 = 0,15/1,5 = 0,1 mol)
0,1 → 0,05 0,05
(3) 2H2O → 2H2 + O2
x
m dung dịch giảm = mCu + mCl2 + mH2 + mO2 => 18,95 = 0,1.64 + 0,15.71 + 0,05.2 + 18x => x = 0,1
n e = 2nCu + 2nH2(2) + 2nH2(3) = 0,1.2 + 0,05.2 + 0,1.2 = 0,5 mol
=> t = 0,5.96500/2,68 = 18003 giây = 5 giờ

Chọn đáp án B
- Ta có
n e t r a o đ ổ i = I t 96500 = 0 , 44 m o l
Quá trình điện phân xảy ra như sau:
| Tại anot |
Tại catot |
| C u 2 + + 2 e → C u 0 , 15 0 , 3 0 , 15 2 H 2 O + 2 e → 2 O H - + H 2 0 , 08 0 , 04 |
2 C l - → C l 2 + 2 e x → 2 x H 2 O → 4 H + + 4 e + O 2 4 x → y |
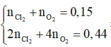

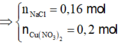
- Dung dịch sau điện phân chứa
![]()
+ Xét dung dịch sau điện phân có:
![]()
mol
- Cho m gam Fe tác dụng với dung dịch trên thì:
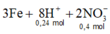
![]()
+ Theo đề ta có: m F e - m r ắ n k h ô n g tan = m F e tan
=> m - 0,8m = 0,09.56 => m = 25,2 (g)

Chọn B
Giả sử tại anot chỉ có Cl2 ⇒ nCl2 = 0,15 mol ⇒ ne = 0,3 mol < 0,44 mol ⇒ vô lí!.
⇒ khí gồm Cl2 và O2 với x và y mol || nkhí = x + y = 0,15 mol; ne = 2x + 4y = 0,44 mol.
⇒ giải hệ có: x = 0,08 mol; y = 0,07 mol ⇒ nNaCl = 0,16 mol ⇒ nCu(NO3)2 = 0,2 mol.
ne > 2nCu2+ ⇒ H2O bị điện phân tại catot ⇒ nOH– = 0,44 – 0,2 × 2 = 0,04 mol.
H+ + OH– → H2O ⇒ H+ dư 0,07 × 4 – 0,04 = 0,24 mol; nNO3– = 0,4 mol.
Xét Fe + dung dịch sau điện phân: do thu được rắn ⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2.
3Fe + 8H+ + 2NO3– → 3Fe2+ + 2NO + 4H2O ⇒ nFe phản ứng = 0,09 mol.
m – 0,09 × 56 = 0,8m ⇒ m = 25,2(g)


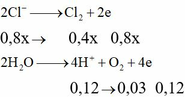

Đáp án B
Ta có: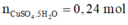
Điện phân X đến khi dung dịch giảm 24,88 gam thì dừng. Dung dịch thu được 2 chất tan. Cho Mg vào Y thấy thành Mg giảm 3,36 gam chứng tỏ có H+.
Do vậy hai chất tan trong Y là H2SO4 và Na2SO4
Cu2+ bị điện phân hết và có sinh ra 0,28 mol H+
=>
Dung dịch bị giảm do Cu2+, Cl- và H2O bị điện phân.
Giải được: x=0,01.
Vậy ở anot thu được 0,1 mol Cl2 và 0,075 mol O2.