Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

vì đề không nói là H2SO4 đặc nóng nên mình coi là đặc nguội nha. H2SO4 đặc nguội thụ động với Fe nên không xảy ra phản ứng.

a) Kim loại M và Ag khi cho tác dụng với dung dịch H2SO4 dư thì Ag không phản ứng , mà axit dư nên kim loại M phản ứng hết , chất rắn thu được sau phản ứng là Ag .
=> mAg = 30,4 gam và mM = 40- 30,4 =9,6 gam
=> %mAg = \(\dfrac{30,4}{40}\).100=76% => %mM = 100-76 = 24%
b) Giả sử kim loại M có hóa trị n
PTHH : 2M + nH2SO4 → M2(SO4)n + nH2
nH2 = 8,96/22,4 = 0,4 mol => nM =\(\dfrac{0,8}{n}\)
<=> MM = \(\dfrac{9,6.n}{0,8}\)= 12n
=> n = 2 và MM = 24(g/mol) , M là magie ( Mg )
a) Kim loại M và Ag khi cho tác dụng với dung dịch H2SO4 dư thì Ag không phản ứng , mà axit dư nên kim loại M phản ứng hết , chất rắn thu được sau phản ứng là Ag .
=> mAg = 30,4 gam và mM = 40- 30,4 =9,6 gam
=> %mAg = 30,44030,440.100=76% => %mM = 100-76 = 24%
b) Giả sử kim loại M có hóa trị n
PTHH : 2M + nH2SO4 → M2(SO4)n + nH2
nH2 = 8,96/22,4 = 0,4 mol => nM =0,8n0,8n
<=> MM = 9,6.n0,89,6.n0,8= 12n
=> n = 2 và MM = 24(g/mol) , M là magie ( Mg )

2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Fe + H2SO4 → FeSO4 + H2
nH2=\(\dfrac{8,96}{22,4}\)= 0,4 mol
Gọi số mol của Al và Fe trong 11 gam hỗn hợp là x và y mol ta có:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\)=> x = 0,2 và y = 0,1
Theo tỉ lệ phương trình => nH2SO4 cần dùng = nH2 = 0,4 mol
=> VH2SO4 cần dùng = \(\dfrac{0,4}{2}\)= 0,2 lít
%mAl = \(\dfrac{0,2.27}{11}.100\)= 49,1% => %mFe = 100- 49,1 = 50,9%

PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,04\left(mol\right)\Rightarrow m_{Zn}=0,04.65=2,6\left(g\right)\)
⇒ mCu = 9 - 2,6 = 6,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{9}.100\%\approx28,89\%\\\%m_{Cu}\approx71,11\%\end{matrix}\right.\)

\(a.Al,Ag+H_2SO_4\rightarrow ChỉcóAlphảnứng,chấtrắnsauphảnứnglàAg\\ n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ TheoPT:n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\\ \Rightarrow m_{Al}=0,1.27=2,7\left(g\right)\\ \Rightarrow m_{rắnsaupu}=m_{Ag}=15,4-2,7=12,7\left(g\right)\\ b.\%m_{Al}=\dfrac{2,7}{15,4}.100=17,53\%,\%m_{Ag}=100-17,53=82,47\%\)

\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.1.......0.2......................0.1\)
Chất rắn X : Cu
\(m_{Zn}=0.1\cdot65=6.5\left(g\right)\Rightarrow m_{Cu}=19.3-6.5=12.8\left(g\right)\)
\(n_{Cu}=\dfrac{12.8}{64}=0.2\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(2Cu+O_2\underrightarrow{^{^{t^o}}}2CuO\)
\(0.2........0.1\)
\(m_{tăng}=m_{O_2}=0.1\cdot32=3.2\left(g\right)\)
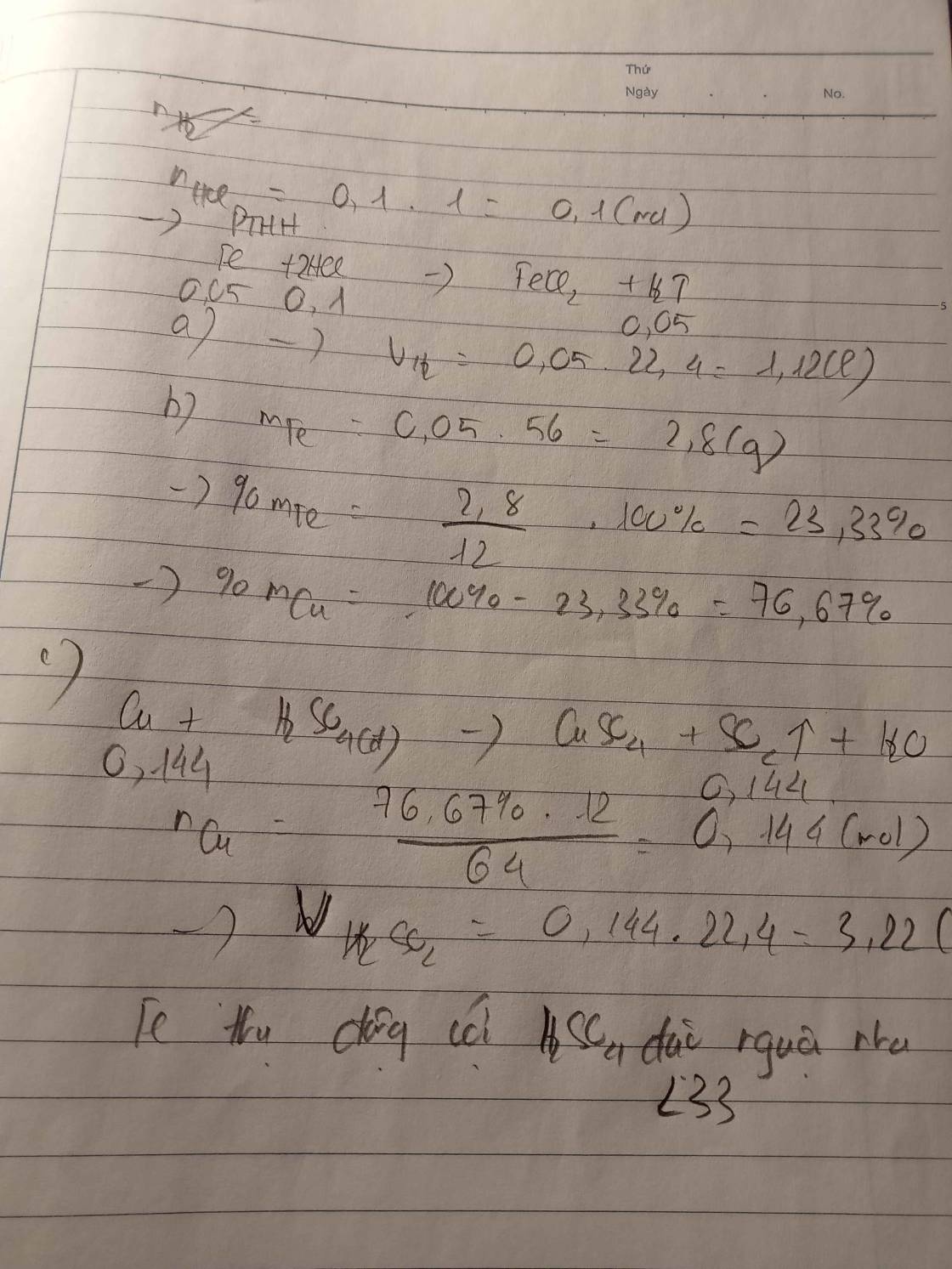
PTHH:
\(Cu+HCl--\times-->\)
\(2Ag+2HCl--->2AgCl\downarrow+H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Ag}=2.n_{H_2}=2.0,15=0,3\left(mol\right)\)
=> \(m_{Ag}=0,3.108=32,4\left(g\right)>5,9\left(g\right)\)
(Sai đề nhé.)