Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH+=0,4+0,1.a
nNO3-=0,1a
bạn viết phương trình Mg+H+ +NO3- dưới dạng pt ion
H++NO3 ttuowng đương với HNO3 loãng
rồi bạn sử dụng phương pháp đường chéo, định luật bảo toàn nguyên tố và electron

\(\text{a) N2+3H2->2NH3}\)
\(\text{4NH3+5O2->4NO+6H2O}\)
\(\text{2NO+O2->2NO2}\)
\(\text{O2+4NO2+2H2O->4HNO3}\)
b)
nN2=112000/22,4=5000(mol)
=>nHNO3=10000(mol)
hao hụt 15%
=>nHNO3=8500(mol)
\(\Rightarrow\text{mdd HNO3=8500x63/63%=850000(g)=0,85(tấn)}\)

Goi nAl2O3=x mol ,nH2=0,6mol
2Al + 6HCl →2AlCl3 + 3H2
0,4mol<--- 0,4 <--- 0,6mol
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,1mol --->0,2
Ta co: 0,4.27 + x.102 = 21 ==> x=0,1 mol
ΣnAlCl3= 0,4 + 0,2 = 0,6 mol ---> nAl3+=0,6 mol
n↓=0,4 mol
pt ion rut gon giau NaOH tac dung voi dd A
Al3+ +3OH- → Al(OH)3↓
0,12<----- 0,4
==> VNaOH= 0,12:0,5 = 2,4lit==> A
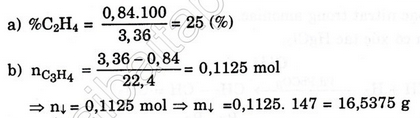

nCu = 0,3
nNaNO3 = 0,5
nHCl = 1
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Đb: 0,3 1 0,3
Cu hết; n NO = 2/3n Cu = 0,2 mol
VNO = 4,48l
Đáp án B.