Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Đặt:\)
\(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
\(m_{hh}=24x+56y=13.6\left(g\right)\\ n_{H_2}=x+y=0.3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0.1\\y=0.2\end{matrix}\right.\)
\(\%Mg=\dfrac{0.1\cdot24}{13.6}\cdot100\%=17.64\%\\ \%Fe=100-17.64=82.36\%\)
\(n_{HCl}=2n_{H_2}=2\cdot0.3=0.6\left(mol\right)\)
\(V_{HCl}=\dfrac{0.6}{2}=0.3\left(l\right)\)
\(m_Y=m_{MgCl_2}+m_{FeCl_2}=0.1\cdot95+0.2\cdot127=34.9\left(g\right)\)

Quy đổi X thành \(\left\{{}\begin{matrix}FeO:a\left(mol\right)\\Fe_2O_3:b\left(mol\right)\end{matrix}\right.\)
Phần 1: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
=> 127.0,5a + 162,5b = 74,15
=> 63,5a + 162,5b = 74,15 (1)
Phần 2: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
PTHH: 2FeCl2 + Cl2 --> 2FeCl3
0,5a------------>0,5a
=> 162,5(0,5a + b) = 81,25
=> 0,5a + b = 0,5 (2)
(1)(2) => a = 0,4 (mol); b = 0,3 (mol)
=> m = 0,4.72 + 0,3.160 = 76,8 (g)

\(n_{H_2}=\dfrac{0,336}{22,4}=0,015mol\)
\(\Rightarrow n_{HCl}=2n_{H_2}=2\cdot0,015=0,03mol\)
\(\Rightarrow n_{Cl^-}=0,03mol\Rightarrow m_{Cl^-}=1,065g\)
\(m_{CRắn}=m_{kl}+m_{Cl^-}=1,065+1,5=2,565g\)

nHCl= 0,4.2,75=1,1(mol)
=> nH+=nCl-=nHCl= 1,1(mol)
m=m(muối)= mCl- + m(hh kim loại)= 35,5.1,1 + 25,3= 64,35(g)
nH2= nH+/2= 1,1/2= 0,55(mol)
=> V=V(H2,đktc)= 0,55.22,4=12,32(l)
em học lớp 6 và bài này em tự làm , mong các senpai tick cho em ạ

B3:
Bài 3 người ta cho các kim loại sau đây là những kim loại nào thế?
B2:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ AlCl_3+3NaOH\rightarrow3NaCl+Al\left(OH\right)_3\downarrow\\ MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\\ Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+H_2O\\ Mg\left(OH\right)_2\rightarrow\left(t^o\right)MgO+H_2O\\ Đặt:n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\left(a,b>0\right)\\ \Rightarrow\left\{{}\begin{matrix}27a+24b=10\\40b=6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=\dfrac{32}{135}\\b=0,15\end{matrix}\right.\\ \Rightarrow\%m_{Mg}=\dfrac{0,15.24}{10}.100\%=36\%\)
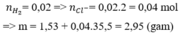
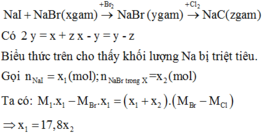
Do tính khử Zn > Fe nên Zn phản ứng trước.
Do khối lượng rắn khan ở thí nghiệm 2 > thí nghiệm 1.
Do đó, ở thí nghiệm 1 HCl hết, kim loại có thể dư. Ở thí nghiệm 2, kim loại hết, HCl có thể dư.
Zn+2HCl→ZnCl2+H2Fe+2HCl→FeCl2+H2nZn=a;nFe=bmA=65a+56b=18,6mchất rắn=136a+127b=39,9⇒a=0,2;b=0,1⇒mZn=0,2.65=13(gam);mFe=0,1.56=5,6(gam)Zn+2HCl→ZnCl2+H2Fe+2HCl→FeCl2+H2nZn=a;nFe=bmA=65a+56b=18,6mchất rắn=136a+127b=39,9⇒a=0,2;b=0,1⇒mZn=0,2.65=13(gam);mFe=0,1.56=5,6(gam)
Thí nghiệm 1 :
nFe pư=x(mol);nFe dư=y(mol)⇒x+y=0,1(1)nFeCl2=x(mol)⇒mchất rắn=0,2.136+127x+56y=34,575(2)(1)(2)⇒x=0,025;y=0,075nHCl=2nZn+2nFe pư=0,2.2+0,025.2=0,45(mol)CMHCl=0,450,5=0,9M