Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH :
\(2Fe+3X2-^{t0}->2FeX3\)
0,1mol..0,15mol..............0,1mol
Cách 1 :
Ta có : MFeX3 = \(\dfrac{16,25}{0,1}=162,5\left(\dfrac{g}{mol}\right)=>MX=\dfrac{162,5-56}{3}=35,5\)(g/mol)
=> X là Clo
Cách 2 :
Áp dụng ĐLBTKl ta có :
mFe + mX2 = mFeX3
=> mX2 = 16,25-5,6 = 10,65(g)
=> MX2 = \(\dfrac{10,65}{0,15}=71=>X=35,5\)
=> X là clo

\(n_{K}=\dfrac{3,9}{39}=0,1(mol)\\ PTHH:2K+X_2\to 2KX\\ \Rightarrow n_{K}=n_{KX}=0,1(mol)\\ \Rightarrow M_{KX}=\dfrac{5,8}{0,1}=58(g/mol)\\ \Rightarrow M_{x}=58-39=19(g/mol)\)
Vậy X là Flo (F)

Chọn đáp án A
(1) Trong nhóm halogen, tính phi kim và độ âm điện giảm dần từ flo đến iot.
Đúng.Theo SGK lớp 10.
(2) Các halogen đều có các trạng thái oxi hóa -1, 0, +1, +3,+5, +7.
Sai.Flo chỉ có -1 và 0
(3) Các halogen đều có tính oxi hóa mạnh, chúng phản ứng được với hầu hết kim loại, với hiđro và nhiều hợp chất.
Đúng.Theo SGK lớp 10
(4) Trong dãy axit không chứa oxi của halogen từ HF đến HI tính axit và tính khử tăng dần.
Sai.Tính khử và tính axit giảm dần
(5) Cho các dung dịch muối NaX (X là halogen) tác dụng với dung dịch AgNO3 đều thu được kết tủa AgX.
Sai.AgF là chất tan

KH nguyến tố halogen là X , đặt a là số mol ptu X2
ptpu:
Mg + X2 ----> MgX2
mol : a−−>a
2Al + 3X2 ---> 2AlX3
mol: a−−−>\(\frac{2a}{3}\)
từ pt => (24 + 2X).a =19 => a=\(\frac{19}{24+2X}\)
(27 + 3X).1,5a =17,8 => a= \(\frac{17,8.3}{\left(27+3X\right).2}\) =>X=35,5
![]()

Gọi tên của đơn chất halogen là X
\(Fe+3X\underrightarrow{t^o}FeX_3\)
ta có :\(\dfrac{56}{11,2}=\dfrac{56+3X}{32,5}\) => X = 35,5
Vậy X là Clo ( Cl )
nFe = 0,2 mol
Fe + 3M → FeM3
0,2..................0,2
⇒ \(\dfrac{32,5}{56+3M}\) = 0,2
⇔ 32,5 = 11,2 + 0,6M
⇔ 21,3 = 0,6M
⇔ M = 35,5 (Cl)
Vậy M là clo

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca

a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
Mg + X2 → MgX2
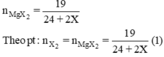
2Al + 3X2 → 2AlX3.
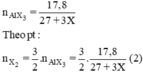
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) Thay X = 35,5 vào (1) ⇒ nCl2 = 0,2 mol ⇒ mCl2 = 14,2g.


Theo đề, ta có: mức oxi hóa của Fe trong hợp chất với halogen X là +3. Vậy, hợp chất halogen của X với Fe có dạng: FeX3.
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: \(2Fe+3X_2\rightarrow2FeX_3\left(1\right)\)
Số mol: 0,3 -----> 0,45
Theo (1), \(n_{X_2}=\dfrac{3}{2}n_{Fe}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\left(2\right)\)
Mặt khác, ta có: \(m_{X_2}=72\left(g\right)\)
\(\Rightarrow n_{X_2}=\dfrac{72}{2.X}\left(3\right)\)
Từ (2) và (3), ta có: \(\dfrac{72}{2.X}=0,45\Leftrightarrow X=80\)
Vậy X là Brom.