


Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

CuO + H2 => Cu +H2O
a => a => a
FexOy +yH2 => xFe + yH2O
a => ay => ax
Fe + 2Hcl => FeCl2 + h2
0,02 <= 0,02
Ta có n O p/ư= (2,4-1,76): 16=0,04= ay +y => a = 0,04/(y+1)
Mặt khác : ax= 0,02 => a =0,02/x
=> x = 2 , y =3
Fe2O3
Khối lượng chất rắn giảm chính là khối lượng oxi.
-->nO= (2,4 - 1,76)/16 = 0,04 mol -->mO=0,64(g)
Ta có nFe=nH2=0,02.-->mFe=1,12(g)
Ta có m(hỗn hợp BĐ)= mCu+mFe+mO=2,4
-->mcu= 0,64 -->nCu=0,01mol
Hỗn hợp ban đầu có: CuO: 0,01 mol
FexOy: a mol
Ta có nO=0,01+ya=0,04-->ya=0,03
nFe=xa=0,02
Ta có nFe/nO=2/3
Vậy oxit sắt là Fe2O3.

*Sửa đề: Tính %m của Oxi
Với bài này thì ko cần viết phương trình đâu bạn nhé :))
Coi hỗn hợp A gồm Fe (a mol) và O (b mol) \(\Rightarrow56a+16b=49,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,8\) (2)
Từ (1) và (2) \(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,7\\b=0,65\end{matrix}\right.\) \(\Rightarrow\%m_O=\dfrac{0,65\cdot16}{49,6}\cdot100\%\approx20,97\%\)

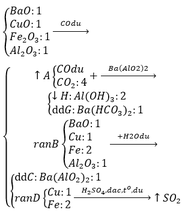
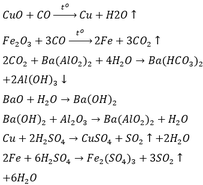
Gọi $n_{Fe} = n_{Fe_2O_n} = a(mol)$
Ta có :$56a + a(112 + 16n) = 14,4(1)$
$n_{SO_2} = 0,1(mol)$
Bảo toàn electron :
$3a + a(3 - n) = 0,1.2(2)$
Từ (1)(2) suy ra : $a = \dfrac{1}{15} ; an = 0,2$
Suy ra: $n = an :a = 3$
Vậy oxit là $Fe_2O_3$
Gọi nFe=nFe2On=a(mol)nFe=nFe2On=a(mol)
Ta có :56a+a(112+16n)=14,4(1)56a+a(112+16n)=14,4(1)
nSO2=0,1(mol)nSO2=0,1(mol)
Bảo toàn electron :
3a+a(3−n)=0,1.2(2)3a+a(3−n)=0,1.2(2)
Từ (1)(2) suy ra : a=115;an=0,2a=115;an=0,2
Suy ra: n=an:a=3n=an:a=3
Vậy oxit là Fe2
Đúng(1)