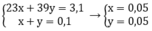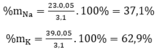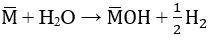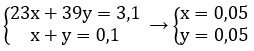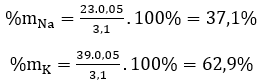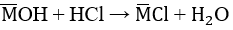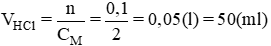Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam

Gọi số mol Zn, AL là a, b (mol)
=> 65a + 27b = 3,79 (1)
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
a---->a------------------->a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b---->1,5b-------------------->1,5b
=> a + 1,5b = 0,08 (2)
(1)(2) => a = 0,05; b = 0,02
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,05.65}{3,79}.100\%=85,752\%\\\%m_{Al}=\dfrac{0,02.27}{3,79}.100\%=14,248\%\end{matrix}\right.\)
\(n_{H_2SO_4}=a+1,5b=0,08\left(mol\right)\)
=> \(m_{H_2SO_4}=0,08.98=7,84\left(g\right)\)
Zn + H2SO4 -> ZnSO4 + H2
a -> a
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
b -> 1.5b
HPT: 65a+27b=3.79
a + 1.5b = 1.792/22.4= 0.08
Giải HPT ta được a=0.05 b=0.02
mZn = 0.05*65=3.25 (g)
mAl= 0.02*27=0.54 (g)

Đáp án C
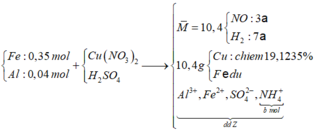
nCu = (10,4. 0,191235 )/64= 0,03 (mol) => nCu(NO3)2 = 0,03
=> nFe dư = ( 10,4 -0,03.64)/56 = 0,145 (mol) => nFe pư = 0,35 – 0,145 = 0,205 (mol)
Hỗn hợp khí có M = 10,4 => Dùng quy tắc đường chéo => nNO = 3a và nH2 = 7a (mol)
Bảo toàn nguyên tố N ta có: nNO + nNH4+ = 2nCu(NO3)2
=> 3a + b = 0,03.2 (1)
Bảo toàn e: 2nFe pư + 3nAl = 3nNO + 2nH2 + 8nNH4+ + 2nCu2+
=> 2.0,205 + 3. 0,04 = 3.3a + 2.7a + 8b + 2. 0,03
=> 23a + 8b = 0,47 (2)
Từ (1) và (2) => a = 0,01 và b = 0,03 (mol)
Bảo toàn điện tích với dung dịch Y gồm Al3+ (0,04 ); Fe2+: (0,205); NH4+ (0,03) và SO42-
=> 3.0,04 + 2.0,205 = 0,03 + 2nSO4
=> nSO4 = 0,28 (mol)
=> mmuối = mAl3+ + mFe2+ + mNH4+ + mSO42-
= 0,04.27 + 0,205.56 + 0,03.18 + 0,28.96
= 39,98 (g)
% Al2(SO4)3 = (0,02. 342) :39,98 ).100% = 17,11% ≈ 17,15%

a) Gọi công thức chung của 2 kim loại kiềm là M
2M + 2H2O → 2MOH + H2
nH2nH2 = 0,05 mol ⇒ nM= 2nH2 =0,1 mol
⇒ M = 3,1/0,1= 31 (g/mol); Vậy 2 kim loại đó là Na (23) và K (39)
Gọi x là số mol kim loại Na, ⇒ nK = 0,1 – x (mol)
ta có: m hỗn hợp = mNa + mK
⇔ 3,1 = 23x + 39(0,1 - x)
⇒ x = 0,05 mol
%mNa=mNa/mhh*100%=23*0,05/3,1*100%*100%= 37,1%;
% mK = 100% - 37,1% = 62,9%.
b) HCl + MOH → MCl + H2O
nHCl =nMOH = 0,1 mol ⇒Vdung dịch HCl = n/CM=0,1/2=0,05lítnCM=0,12=0,05lí
mhh muối= mKL + mCl= 3,1 + 35,5.0,1= 6,65 (gam)
a. Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 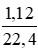
PTHH:
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 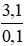
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
b.
Theo pt: nHCl = nMOH = 0,1 (mol)
m(MCl) = 0,1.(31 + 35,5) = 6,65(g)

Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 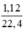 = 0,05(mol)
= 0,05(mol)
PTHH: 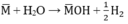
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 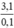 = 31 → Na, K
= 31 → Na, K
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình: