Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) nCH3COOH= 0,4(mol)
PTHH: CH3COOH + NaOH -> CH3COONa + H2O
0,4____________0,4(mol)
=> mNaOH=0,4. 40=16(g)
b) nCH3COOH= 1(mol)
nC2H5OH= 100/46= 50/23(mol)
Vì : 1/1< 50/23 :1
=> C2H5OH dư, CH3COOH hết, tính theo nCH3COOH.
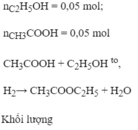
PTHH: CH3COOH + C2H5OH \(⇌\) CH3COOC2H5 + H2O (đk: H+ , nhiệt độ)
Ta có: nCH3COOC2H5(thực tế)= 0,625(mol)
Mà theo LT: nCH3COOC2H5(LT)= nCH3COOH=1(mol)
=>H= (0,625/1).100=62,5%

Gọi x, y lần lượt là số mol của CH3COOH và C2H5OH
X tác dụng vừa đủ với 200 ml dung dịch NaOH 1M => x = 0,2
mX = 60x + 46y = 16,6
=> y = 0,1
=> x : y = 2 : 1
=> 0,9 mol X có chứa 0,6 mol CH3COOH và 0,3 mol C2H5OH
=> Tổng C2H5OH = 0,5
Vậy giá trị của m = 35,2 (gam)

nCH3COOH = 60/60 = 1 mol;
nC2H5OH = 100/46 ≈ 2,17 mol.
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Theo phương trình phản ứng, vì lượng C2H5OH dư nên lượng CH3COOC2H5 theo lí thuyết phải tính theo lượng CH3COOH. Theo phản ứng số mol của CH3COOH là 1 mol.
Khối lượng CH3COOH theo lí thuyết = 1.88 = 88 gam.
Thực tế chỉ thu được 55 gam.
Vậy hiệu suất của phản ứng là : H% = 55/88 *100% = 62,5%
Chúc bạn học tốt <3

Đáp án: C
PTHH: C H 3 C O O H + C 2 H 5 O H ⇄ H 2 S O 4 , t 0 C H 3 - C O O C 2 H 5 + H 2 O
Theo PTHH, vì lượng C 2 H 5 O H dư nên lượng C H 3 C O O C 2 H 5 theo lí thuyết phải tính theo lượng C H 3 C O O H .
Theo lí thuyết số mol C H 3 C O O H phản ứng là 1 mol
=> khối lượng C H 3 C O O C 2 H 5 thu được theo lí thuyết = 1.88 = 88 gam
Thực tế chỉ thu được 55 gam
=> hiệu suất phản ứng H = 55 88 . 100 % = 62 , 5 %

Chọn đáp án A
$2C_2H_5OH + 2Na \to 2C_2H_5ONa + H_2$
$CH_3COOH + NaOH \to CH_3COONa + H_2O$
$HCOOH + NaOH \to HCOONa + H_2O$
$CH_3COOC_2H_5 + NaOH \to CH_3COONa + C_2H_5OH$
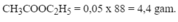
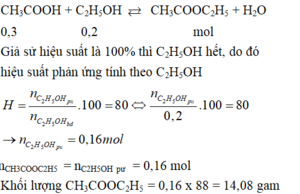

\(n_{CH_3COOH}=\dfrac{120}{60}=2\left(mol\right)\)
\(n_{C_2H_5OH}=\dfrac{46}{46}=1\left(mol\right)\)
\(CH_3COOH+C_2H_5OH⇌CH_3COOC_2H_5+H_2O\left(ĐK:H_2SO_{4\left(đ\right)},t^0\right)\)
\(Bđ:\) \(2.........................1\)
\(Pư:1.......................1.....................1\)
\(KT:1.....................0...................1\)
\(m_{CH_3COOC_2H_5}=1\cdot88=88\left(g\right)\)
\(H\%=\dfrac{52.8}{88}\cdot100\%=60\%\)