Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Đặt số mol Mg, Fe, Al lần lượt là a, b, c
24a + 56b + 27c = 32,9 gam (1)
Từ PTHH: nH2 = a + b + 1,5c = 0,95 mol (2)
Số nguyên tử Al gấp ba lần số nguyên tử Mg ➝ nAl = 3nMg hay c = 3a (3)
Từ (1), (2), (3) có hệ ba phương trình ba ẩn
➝ a = 0,1, b = 0,4, c = 0,3
➝ %mMg = 7,295%, %mFe = 68,085, %mAl = 24,62%
2.
a) Phân tử khối của chất nặng nhất trong hỗn hợp: 44 (CO2)
Phân tử khối của chất nhẹ nhất trong hỗn hợp: 28 (N2)
➝ Phân tử khối trung bình của hỗn hợp: 44 > M > 28
➝ Hỗn hợp X nhẹ hơn khí CO2
b) Khối lượng của hỗn hợp: m = 28a + 32b + 44c (gam)
Tổng số mol của hỗn hợp: n = a + b + c (mol)
Phân tử khối của silan: 28 + 4 = 32 (g/mol)
Phân tử khối trung bình của hỗn hợp = (tổng khối lượng)/(tổng số mol)
\(\dfrac{28a+32b+44c}{a+b+c}=32\)
28a + 32b + 44c = 32a + 32b + 32c
Rút gọn: 4a = 12c hay a : c = 3
Vậy cần lấy tỉ lệ mol giữa N2 và CO2 là 3 : 1, lượng O2 lấy bao nhiêu không quan trọng, sẽ thu được hỗn hợp X nặng bằng khí silan

Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 11 (1)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y\left(mol\right)\)
\(\Rightarrow\dfrac{3}{2}x+y=0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11}.100\%\approx49,1\%\\\%m_{Fe}\approx50,9\%\end{matrix}\right.\)
Bạn tham khảo nhé!
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_{hh}=27a+56b=11\left(g\right)\left(1\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(\Rightarrow1.5a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.1\)
\(m_{Al}=0.2\cdot27=5.4\left(g\right)\)
\(\%Al=\dfrac{5.4}{11}\cdot100\%=49.09\%\)
\(\%Fe=50.91\%\)

a)2Al+6HCl ->2AlCl3+3H2
nAl=5.4/27=0.2mol
suy ra nH2=3/2*nAl=0.2 *3/2=0.3mol
suy ra VH2=0.3*22.4=6.72 l
b)C1 :nHCl =3*nAl=3*0.2=0.6 mol
suy ra mHCl=0.6*36.5=21.9 g
C2:nAlCl3=nAl=0.2 mol
suy ra mAlCl3=0.2*133.5=26.7g
Ta có :mHCl=mAlCl3-mH2-mAl=26.7+0.3*2-5.4=21.9g
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
a) Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(\Rightarrow n_{H_2}=0,3mol\) \(\Rightarrow V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\)
b)
+) Cách 1:
Theo PTHH: \(n_{HCl}=3n_{Al}=0,6mol\) \(\Rightarrow m_{HCl}=0,6\cdot36,5=21,9\left(g\right)\)
+) Cách 2:
Theo PTHH: \(n_{Al}=n_{AlCl_3}=0,2mol\) \(\Rightarrow m_{AlCl_3}=0,2\cdot133,5=26,7\left(g\right)\)
Ta có: \(m_{H_2}=0,3\cdot2=0,6\left(g\right)\)
Bảo toàn khối lượng: \(m_{HCl}=m_{AlCl_3}+m_{H_2}-m_{Al}=21,9\left(g\right)\)
c) Ta có: \(n_{AlCl_3}=0,2mol\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2mol\\n_{Cl}=0,6mol\end{matrix}\right.\)

Đề 15:
1) Theo đề bài , ta có:
NTK(Y)= 2.NTK(Ca)= 2.40=80 (đvC)
=> Nguyên tố Y là brom, KHHH là Br.
2) - Đơn chất là chất do 1nguyên tố tạo thành.
VD: O3; Br2 ; Cl2;......
- Hợp chất là những chất do 2 hay nhiều nguyên tố hóa học trở lên tạo thành.
VD: NaCl, KMnO4, CuSO4, H2O;....
3) Khôi lượng mol? tự trả lời đi !
a) Khối lượng mol của phân tử gồm 2C và 4H
Có nghĩa là khối lượng mol của C2H4
\(M_{C_2H_4}\)= 2.12+4.1=28 (g/mol)
\(M_{H_2S}\)=2.1+32=34(g/mol)

a) PTHH là: 2Al + H2SO4 → Al2(SO4) + H2.
Tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của ba chất trong phản ứng đều là 2:1
b) nAl =27/27 = 1 (mol)
theo PTHH ta có: số mol của H2SO4 = 1/2 * nAl = 1/2*1 =0.5 (mol)
khối lượng của H2SO4 là: 0.5 * (1*2+32+16*4) =49 (g).

a)
2Al + 6HCl --> 2AlCl3 + 3H2
Fe + 2HCl --> FeCl2 + H2
b)Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11 (1)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--->3a-------->a------>1,5a
Fe + 2HCl --> FeCl2 + H2
b---->2b------>b---->b
=> \(n_{H_2}=1,5a+b=\dfrac{8,96}{22,4}=0,4\left(mol\right)\) (2)
(1)(2) => a = 0,2; b = 0,1
mHCl = (0,6 + 0,2).36,5 = 29,2 (g)
=> \(m_{ddHCl}=\dfrac{29,2.100}{9,125}=320\left(g\right)\)
mdd sau pư = 11 + 320 - 0,4.2 = 330,2 (g)
\(\left\{{}\begin{matrix}C\%_{AlCl_3}=\dfrac{0,2.133,5}{330,2}.100\%=8,086\%\\C\%_{FeCl_2}=\dfrac{0,1.127}{330,2}.100\%=3,846\%\end{matrix}\right.\)
Đặt: nAl = a (mol); nFe = b (mol)
27a + 56b = 11 (g) (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2
Mol: a ---> 3a ---> a ---> 1,5a
Fe + 2HCl -> FeCl2 + H2
Mol: b ---> 2b ---> b ---> b
nH2 = 1,5a + b = 0,4 (mol)
Từ (1)(2) <=> a = 0,2 (mol); b = 0,1 (mol)
Còn C% bạn tự tính

n
F
e
=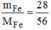 =0,5(mol)
=0,5(mol)
Số nguyên tử của Fe là: 0,5.6. 10 23 = 3. 10 23 nguyên tử hoặc 0,5N nguyên tử .
n
C
u
=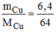 =0,1(mol)
=0,1(mol)
Số nguyên tử của Cu là: 0,1.6. 10 23 = 0,6. 10 23 nguyên tử hoặc 0,1N nguyên tử.
n
A
l
=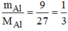 (mol)
(mol)
Số nguyên tử của Al là: (1/3) . 6. 10 23 = 2. 10 23 nguyên tử hoặc 1/3.N nguyên tử.

Số nguyên tử Al: số phân tử H 2 S O 4 = 2:3
Số nguyên tử Al : số phân tử A l 2 S O 4 3 = 2: 1
Số nguyên tử Al : số phân tử H 2 = 2:3

Ta có : \(Al:S:O=2:3:12\)
\(\Rightarrow CTPT:Al_2\left(SO_4\right)_3\)
\(\Rightarrow n_{Al2\left(SO4\right)3}=\dfrac{m}{M}=1,66.10^{-23}\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=3,32.10^{-23}\\n_S=4,98.10^{-23}\\n_O=1,992.10^{-22}\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}Al\approx20\\S\approx30\\O\approx120\end{matrix}\right.\) nguyên tử .
Vậy ...
Gọi số mol của Fe là a (a> 0)
=> số mol của Al là 2a
Theo bài ra ta có:
56a + 2a.27 = 11 => 110a = 11
=> a = 0,1 (mol)
Fe + 2HCl ---> FeCl2 + H2
0,1 0,1 (mol)
2Al + 6HCl ---> 2AlCl3 + 3H2
0,2 0,3 (mol)
=> nH2 = 0,1 + 0,2 = 0,3 (mol)
=> VH2 = 0,3.22,4 = 6,72 (l)