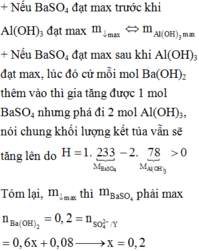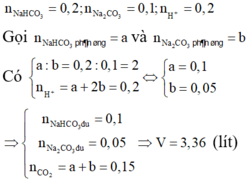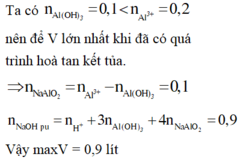Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)

Nhận thấy 3 < nOH- : nAl3+ = 1,4 : 0,4 < 4 → xảy ra quá trình hòa tan kết tủa
Al3+ + 3OH- → Al(OH)3↓
x------3x
Al3+ + 4OH- → Al(OH)4-
y-------4y
Ba2+ + SO42- → BaSO4↓
0,7-----0,6------->0,6
Ta có hệ 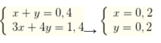
Vậy kết tủa gồm nAl(OH)3 = 0,2 mol, nBaSO4 = 0,6 mol
Nung kết tủa đến khối lượng không đổi: Al2O3: 0,1 mol và nBaSO4 = 0,6 mol → mchất rắn = 150 gam.
Đáp án A

Đáp án A
Số mol 0,04 mol H2SO4; 0,02 mol Fe2(SO4)3; 0,75 mol Ba(OH)2
H++ OH- → H2O
0,08 0,08
Fe3++ 3OH-→ Fe(OH)3
0,04 0,12 0,04
Ba2++ SO42-→ BaSO4
0,75 0,1 0,1
mkết tủa = mFe(OH)3+ mBaSO4 = 0,04.107+ 0,1.233 = 27,58 gam

Nhận thấy 36,9 gam kết tủa gồm BaSO4 : 0,15 mol và Al(OH)3 : 0,025 mol
Vì nAl(OH)3 = 0,025 mol < <nOH- = 0,3 + 0,3x mol → xảy ra hiện tượng hòa tan kết tủa
Al3+ + 3OH- → Al(OH)3
Al3+ + 4OH- → Al(OH)4-
Luôn có 4nAl3+ = nOH- + nAl(OH)3 → nOH- = 0,3 + 0,3x = 4×0,1 -0,025= 0,375 mol → x= 0,25 mol
→ Đáp án B

\(HCO_3^-+OH^-\rightarrow CO_3^{2-}+H_2O\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
\(n_{Ba^{2+}}=0,15+0,1=0,25\left(mol\right)\)
\(n_{HCO_3^-}=0,2\left(mol\right)\)
\(n_{OH^-}=0,2\left(mol\right)\)
\(\Rightarrow n_{CO_3^{2-}}=0,2\left(mol\right)\)
\(\Rightarrow n_{BaCO_3\downarrow}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaCO_3\downarrow}=0,2.197=39,4\left(g\right)\)