Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
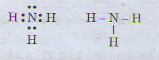

Chọn câu trả lời đúng:
1. Tổng số hạt nguyên tử của một nguyên tố là 40. Biết số hạt nơtron lớn hơn số hạt proton là 1. Nguyên tố trên thuộc loai6 nguyên tố
A. nguyên tố s B. nguyên tố p C. nguyên tố d D. nguyên tố f
2.Về mức năng lượng của các electron trong nguyên tử, điều khẳng định nào sau đây là sai?
A. Các electron ở lớp K có mức năng lượng thấp nhất
B. Các electron ở lớp ngoài cùng có mức năng lượng trung bình cao nhất
C. Các electron ở lớp K có mức năng lượng cao nhất
D. Các electron ở lớp K có mức năng lượng bằng nhau
3. Cấu hình không đúng là
A. 1s22s22p63s23p5 B. 1s22s22p63s23p63d94s2 C. 1s22s22p63s23p63d104s1 D. 1s22s22p63s23p63d54s1
4. Ion nào sau đây không có cấu hình electron của khí hiếm?
A. Fe2+ B. Na+ C. Cl- D. Mg2+
5. Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Nguyên tố R và cấu hình electron là:
A. Na, 1s22s22p63s1 B. Mg, 1s22s22p63s2 C. F, 1s22s22p5 D. Ne, 1s22s22p6
6. Đồng và oxi có các đồng vị sau: 126C, 146C, 168O, 178O, 188O. Có thể có bao nhiêu loại phân tử đồng (1) oxit khác nhau tạo nên từ các đồng vị hai nguyên tố đó?
A. 6 B. 8 C. 9 D. 12
7. Cacbon và oxi có các đồng vị sau: 126C, 146C, 168O, 178O, 188O. Có thể có bao nhiêu loại phân tử khí cacbon đioxit khác nhau tạo nên từ các đồng vị cũa bai nguyên tố đó?
A. 8 B. 18 C. 9 D.12
8. Tổng số khối của 2 nguyên tử X, Y là 34. Trong 2 nguyên tử X, Y tổng số hạt mang điện nhiều hơn số hạt không mang điện là 14. Bue6t1 nguyên tử X là đồng vị của nguyên tử Y. Số khối của X và Y là
A. 13 và 21 B. 14 và 20 C. 15 và 19 D. 16 và 18

Theo đề bài, ta có:
n + p + e = 34 (1)
n + 10 = p + e (2)
số p = số e (3)
Thay (2) vào (1), ta có:
(1) => n + n + 10 = 34
2n = 34 - 10
2n = 24
n = 24 : 2
n = 12 (4)
Thay (4) và (3) vào (2), ta có:
(2) => p + p = 12 + 10
2p = 22
p = 22 : 2
p = 11
=> Nguyên tử R có số p = 11 là Natri - Na là nguyên tố kim loại có NTK = 23 đvC

Vì nguyên tử X ( A = 27 ) có CHE : 1s22s22p63s23p1
=> X có 13p, 14n
X ở ô thứ 13 chu kỳ 3, nhóm IIIA

1. C
2. C
3. C
4. B
5. A
6. C
7. B
8. Cation M mang -3 hay +3 hả bạn ơi
1. Nguyên tử nguyên tố X có 1e lớp ngoài cùng và có tồng số e ở phân lớp d và p là 17. Số hiệu của X là:
A. 29 B. 24 C. 25 D. 19
2. Cấu hình electron của ion nào sau đây không giống cấu hình của khí hiếm:
A. Cl B. Mg2+ C. S2- D. Fe3+
3. Một nguyên tử X có tổng số electron ở các phân lớp p là 11. Nguyên tố X thuộc loại:
A. nguyên tố d B. nguyên tố s C. nguyên tố p D. nguyên tố f
4. Nguyên tử của nguyên tố A và B đều có phân lớp ngoài cùng là 2p. Tổng số e ở hai phân lớp ngoài cùng hai nguyên tử này là 3. Vậy số hiệu nguyên tử của A và B lần lượt là:
A. 1&2 B. 5&6 C. 7&8 D. 7&9
5. Biết các electron của nguyên tử lưu huỳnh được phân bố trên 3 lớp electron (K, L, M) lớp ngoài cùng có 6 electron. Số electron ở lớp L trong nguyên tử lưu huỳnh là:
A. 8 B. 6 C. 10 D. 12
6. Nguyên tử R tạo cation R+. Cấu hình e của R+ ở trạng thái cơ bản là 3p6. Tổng số hạt mang điện trong R là:
A. 18 B. 22 C. 38 D. 19
7. Cấu hình e nào sau đây đúng:
A. [Ar}3d34s2 B. [Ar]3d64s2 C. [Ar]3d64s1 D. [Ar]3d54s1

Theo đề ta có hệ:
\(\left\{{}\begin{matrix}2P_M+N_M+4P_X+2N_X=186\\2P_M-N_M+4P_X-2N_X=54\\P_M+N_M-P_X-N_X=21\\2P_M+N_M-2-2P_X-N_X-1=27\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}P_M=26\\N_M=30\\P_X=17\\N_X=18\end{matrix}\right.\)
Vậy M là Fe ; X là Cl
CHe (M) :1s22s22p63s23p64s2
CHe(M2+) :1s22s22p63s23p6
CHe (X) : 1s22s22p63s23p5
CHe(X-) :1s22s22p63s23p6
Câu 2. ta có : P + E + N = 21
mà A = P + N = 15
⇒ E = P = 6
⇒ N = 9