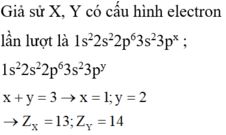Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Cấu hình electron của nguyên tố X, Y lần lượt là 1s22s22p63s23px và 1s22s22p63sy.
Ta có: x + y = 7.
• TH1: y = 1 → x = 6
→ Cấu hình electron của nguyên tố X, Y lần lượt là 1s22s22p63s23p6 và 1s22s22p63s1.
Mà X không phải là khí hiếm → loại.
• TH2: y = 2 → x = 5
→ Cấu hình electron của nguyên tố X, Y lần lượt là 1s22s22p63s23p5 và 1s22s22p63s2.
Vậy điện tích hạt nhân của X, Y lần lượt là X (17+) và Y (12+) → Chọn D.

Đáp án C
TH1: Y có phân lớp ngoài cùng là 3s1
→ Y có cấu hình electron là 1s22s22p63s1
→ Y có 11e → Y có Z = 11.
X có số electron ở phân lớp ngoài cùng = 7 - 1 = 6
→ X có phân lớp ngoài cùng là 3p6 → X là khí hiếm → loại.
• TH2: Y có phân lớp ngoài cùng là 3s2 → tương tự ta có Y có Z = 12.
Khi đó, X có lớp ngoài cùng là 3p5
→ X có cấu hình electron là 1s22s22p63s23p5
→ X có 17 e → Z = 17.

C
TH1: Y có phân lớp ngoài cùng là 3 s 1 → Y có cấu hình electron là 1 s 2 2 s 2 2 p 6 3 s 1
→ Y có 11e → Y có Z = 11.
X có số electron ở phân lớp ngoài cùng = 7 - 1 = 6 → X có phân lớp ngoài cùng là 3 p 6 → X là khí hiếm → loại.
• TH2: Y có phân lớp ngoài cùng là 3 s 2 → Y có cấu hình electron là 1 s 2 2 s 2 2 p 6 3 s 2
→ Y có 12 electron → Y có Z = 12.
Khi đó, X có lớp ngoài cùng là 3 p 5 → X có cấu hình electron là 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5
→ X có 17 e → Z = 17.

A và B có cấu hình electron lần lượt là 1s22s22px và 1s22s22py
Ta có: x + y = 3
Giả sử x = 1 → y = 2 → A có số electron = 5; B có số electron = 6
→ Số hiệu nguyên tử của A và B lần lượt là 5 và 6 → Chọn B.

Đáp án B
Cấu hình của A và B là:
1s22s22px và 1s22s22py
x+y = 3 => x = 1 , y =2 => PA = 5, PB = 6

Đáp án B
Cấu hình của electron của A và B lần lượt là 1s22s22p1 và 1s22s22p2
Số hiệu nguyên tử của A và B lần lượt là:5 và 6.