Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
(III) NH4+, H+, SO42- với Na+, Ba2+, OH-
H+ + OH-→H2O
Ba2++ SO42-→ BaSO4
NH4++ OH-→ NH3+ H2O
(IV) H+, Fe2+, SO42- với Ba2+, K+, OH-
H+ + OH- →H2O
Ba2++ SO42-→ BaSO4
Fe2++ 2OH-→ Fe(OH)2
(V) K+, Na+, HSO3- với Ba2+, Ca2+, OH-
HSO3-+ OH-→SO32-+ H2O
Ba2++ SO32-→ BaSO3
Ca2++ SO32-→ CaSO3
(VI) Cu2+, Zn2+, Cl- với K+, Na+, OH-
Cu2++ 2OH-→ Cu(OH)2
Zn2++ 2OH-→ Zn(OH)2
Zn(OH)2+ 2OH-→ ZnO22- + 2H2O

B. Loại Na+
C. Loại K+
D. Loại Cl-
A. Các phương trình :
\(Fe^{3+}+3OH^-\rightarrow Fe\left(OH\right)_3\)
\(HSO_4^-+OH^-\rightarrow SO_4^{2-}+H_2O\)
\(Cu^{2+}+2OH^-\rightarrow Cu\left(OH\right)_2\)

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn

+ 1/2 X + NaOH dư:
\(n_{BaCO_3}=\dfrac{9,85}{197}=0,05mol\)
\(Ba^{2+}+HCO_3^-+OH^-\rightarrow BaCO_3\downarrow+H_2O\)
................0,05<-----------------0,05
\(\Rightarrow n_{HCO_3^-}=2.0,05=0,1mol\)
+ 1/2 X + NaHSO4 dư:
\(n_{BaSO_4}=\dfrac{17,475}{233}=0,075mol\)
\(HSO_4^-+HCO_3^-\rightarrow SO_4^{2-}+CO_2\uparrow+H_2O\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
\(Ba^{2+}+HSO_4^-\rightarrow BaSO_4\downarrow+H^+\) (nếu có)
\(\Rightarrow n_{Ba^{2+}}=2.0,075=0,15mol\)
Áp dụng định luật bảo toàn điện tích vào dung dịch X:
\(n_{HCO_3^-}+n_{Cl^-}=2n_{Ba^{2+}}+n_{Na^+}\)
\(\Rightarrow0,1+0,3=2.0,15+n_{Na^+}\Rightarrow n_{Na^+}=0,1mol\)
+ Đun nóng X:
\(2HCO_3^-\rightarrow^{t^0}CO_3^{2-}+CO_2\uparrow+H_2O\)
0,1------------>0,05
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
0,05<---0,05------->0,05
\(n_{Ba^{2+}}\text{còn}=0,15-0,05=0,1mol\)
=> Dung dịch X có chứa: 0,1 mol Ba2+; 0,1 Na+; 0,3 mol Cl-
\(\Rightarrow m_{\text{muối}}=137.0,1+23.0,1+35,5.0,3=26,65\left(gam\right)\)

Thí nghiệm 2 :
$HCO_3^- + OH^- \to CO_3^{2-} + H_2O$
$Ca^{2+} + CO_3^{2-} \to CaCO_3$
$n_{HCO_3^-} = n_{CO_3^{2-}} = n_{CaCO_3} = \dfrac{3}{100} = 0,03(mol)$
Thí nghiệm 1 : $Ca^{2+}$ hết $CO_3^{2-}$ dư
$n_{Ca^{2+}} = n_{CaCO_3} = \dfrac{2}{100} = 0,02(mol)$
Vậy X gồm :
$Ca^{2+}(0,02\ mol) ; Na^+ ; HCO_3^-(0,03\ mol) ; Cl^-(0,1\ mol)$
Bảo toàn điện tích : $n_{Na^+} = 0,09(mol)$
Cô cạn thì $HCO_3^- \to CO_3^{2-} + CO_2 + H_2O$
$m = 0,02.40 + 0,09.23 + 0,03.60 + 0,1.35,5 = 8,22(gam)$

Câu 3: Viết PTPT cho các PT ion rút gọn sau:
a. Ag + + Br - AgBr b. Pb 2+ + 2 OH - Pb(OH)2
c. CH3COO - + H + CH3COOH d. S 2- + 2 H + H2S
e. CO3 2- + 2 H + CO2 + H2O f. SO4 2- + Ba 2+ BaSO4
g. HS - + H + H2S h. Pb 2+ + S 2- PbS
Chọn C.
A. \(Cu^{2+}\) \(+\) \(OH^-\) \(\rightarrow Cu\left(OH\right)_2\downarrow\) \(\Rightarrow\) Các chất không tồn tại.
B. \(Ba^{2+}+SO^{2-}_4\rightarrow BaSO_4\downarrow\) \(\Rightarrow\) Các chất không tồn tại.
D. \(HCO^-_3+OH^-\rightarrow CO^{2-}_3+H_2O\)\(\Rightarrow\)Các chất không tồn tại.

Chọn đáp án B.
Các phản ứng có kết tủa hay khí tạo thành đều không thể có phương trình ion như vậy, loại A, C, D
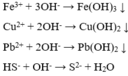
Các cặp ion có thể phản ứng được với nhau là:
\(H^++OH^-\rightarrow H_2O\)
\(H^++HCO_3^-\rightarrow CO_2\uparrow+H_2O\)
\(2H^++2BH_4^-\rightarrow2H_2\uparrow+B_2H_6\uparrow\)
\(NH_4^++OH^-\rightarrow NH_3\uparrow+H_2O\)
\(OH^-+HCO_3^-\rightarrow CO_3^{2-}+H_2O\)
\(OH^-+HSO_4^-\rightarrow SO_4^{2-}+H_2O\)
NH4+ + OH- → NH3 + H2O
H+ + HCO3- → CO2 + H2O
OH- + HCO3- → CO32- + H2O
OH- + HSO4- → SO42- + H2O