Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ĐÁP ÁN B
Tổng số hạt n và p trong hạt nhân nguyên tử này là: 5 , 01.10 − 24 1 , 67.10 − 24 =3
Nguyên tử có 1 electron ở lớp vỏ nguyên tử nên sẽ có 1 proton trong hạt nhân. Suy ra số hạt nơtron trong hạt nhân là 2.

a)
1 electron có khối lượng = 9,11.10-28 gam
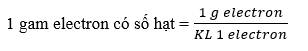
\( = \frac{1}{{9,{{11.10}^{ - 28}}}} = 1,098{\rm{ }} \times {\rm{ }}{10^{27}}\;\) (hạt)
b)
1 electron có khối lượng = 9,11.10-28 gam
1 mol electron có 6,022x1023 hạt electron
=> Khối lượng 1 mol electron = 9,11.10-28 x 6,022x1023 = 5,49.10-4 gam

\(\left\{{}\begin{matrix}Z+N=63\\2Z-N=24\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}Z=29=P=E\\N=34\end{matrix}\right.\)
\(n_X=\dfrac{15,75}{63}=0,25\left(mol\right)\)
=> \(0,25.6.10^{23}.29.2+0,25.6.10^{23}.34=1,38.10^{25}\) (hạt)
=> Chọn A
