
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


vì nhôm pư với clo thep pthh:
2Al+3Cl22AlCl3(1)
theo pthh(1) và đề bài ta có:nAlCl3=26,7:133,5=0,2(mol)
nCl2 =0,2:23=0,3(mol)
mCl2=710,3=21,3(g)
vậy số gam clo cần dùng là 21,3(g)
PT: \(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
Ta có: \(n_{AlCl_3}=\dfrac{26,7}{133,5}=0,2\left(mol\right)\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{AlCl_3}=0,3\left(mol\right)\)
\(\Rightarrow m_{Cl_2}=0,3.71=21,3\left(g\right)\)
Bạn tham khảo nhé!

\(n_{H_2}=\dfrac{2,464}{22,4}=0,11mol\)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow Muối\left\{{}\begin{matrix}Al_2\left(SO_4\right)_3\\FeSO_4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}BTe:3x+2y=2n_{H_2}=0,22\\\dfrac{x}{2}\cdot342+y\cdot152=14,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04mol\\y=0,05mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,04\cdot27=1,08g\\m_{Fe}=0,05\cdot56=2,8g\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_4\downarrow\)
0,02 0,06
\(FeSO_4+BaCl_2\rightarrow BaSO_4\downarrow+FeCl_2\)
0,05 0,05
\(\Rightarrow\Sigma n_{\downarrow}=0,06+0,05=0,11\Rightarrow m_{BaSO_4}=x=25,63g\)

\(n_{FeCl_3}=\dfrac{16.25}{162.5}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{t^0}FeCl_3\)
\(......0.15......0.1\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.06...............0.48........................................0.15\)
\(m_{KMnO_4}=0.06\cdot158=9.48\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{0.48}{1}=0.48\left(l\right)=480\left(ml\right)\)
\(2Fe+ 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = \dfrac{3}{2}n_{FeCl_3} = \dfrac{3}{2}.\dfrac{16,25}{162,5} = 0,15(mol)\\ 2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O\\ n_{KMnO_4} = \dfrac{2}{5}n_{Cl_2} = 0,06(mol)\\ \Rightarrow m_{KMnO_4} = 0,06.158 = 9,48(gam)\\ n_{HCl} = \dfrac{16}{4}n_{Cl_2} = 0,48(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,48}{1} = 0,48(lít) = 480(ml)\)

\(Cu+2AgNO_3\to Cu(NO_3)_2+2Ag\\ \Rightarrow n_{Cu}=\dfrac{1}{2}n_{AgNO_3}=\dfrac{1}{2}.0,2.0,1=0,01(mol)\\ \Rightarrow m_{Cu}=0,01.64=0,64(g)\)

1.
Gọi hóa trị của kim loại M là n, ta có:
\(2M+nCl_2\underrightarrow{^{to}}2MCl_n\)
Dựa vào pt, ta thấy:
nM=nMCln
⇔ 3,2/M=6,75/M+35,5n
⇔ M=32n
Vì M là kim loại nên hóa trị có thể là I, II và III:
- Nếu n=1 ==> M=32 (Loại)
- Nếu n=2 ==> M=64 (Chọn - Cu)
- Nếu n=3 ==> M=96 (Loại)
Vậy kim loại M là Cu.
2.
\(Cu+X_2\underrightarrow{^{to}}CuX_2\)
nX2=2,24/22,4=0,1 (mol)
nCuX2=nX2=0,1 (mol)
==> mCuX2= 0,1.(64 + 2X)=22,4
==> X= 80 (Br)
Vậy halogen X là Br.

Đáp án:
Zn
Giải thích các bước giải:
2M+nCl2->2MCln
theo ĐLBTKL ta có
klM+mCl2=klMCln
=>klCl2=24,85 g
nCl2=224,85/71=0,35 mol
=>VCl2=0,35x22,4=7,84 l
Ta có
nkl=0,35x2/n=0,7/n mol
nkl=22,75:0,7/n=32,5n
n=2 kl=65 kl là Zn
=> kl là kẽm(Zn)
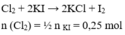
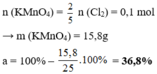

\(Cu + Cl_2 \xrightarrow{t^o} CuCl_2\\ n_{Cu} = n_{CuCl_2}= \dfrac{27}{135} = 0,2(mol)\\ \Rightarrow m_{Cu} = 0,2.64 = 12,8(gam)\)