Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nhúng QT vào dd :
ko đổi màu => NaCl
hóa xanh => KOH
hóa đỏ => H2SO4 và HCl
cho tác dụng với Ba
có khí thoát ra => HCl
có khí thoát ra và có kết tủa => H2SO4
b) cho td với nước : ko tan => Mg và Al2O3
tan có khí thoát ra => Na
tan ko có khí thoát ra => Na2O
còn lại cho tác dụng với NaOH
ko tác dụng => Mg
chất rắn bị hòa tan là Al2O3
2
phân hủy KMnO4 sinh ra O2 để đốt sắt
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
sau đó , cho Zn td với HCl tạo ra H2 để khử Fe3O4
\(Zn+2HCl->ZnCl_2+H_2\)
cho Fe td với HCl tạo ra FeCl2
\(Fe+2HCl->FeCl_2+H_2\)
s cho Ba tác dụng với HCl lại có khí thoát ra ạ, m tưởng là k có hiện tượng g chứ?

Bài 1: Chọn D
| Na2O | SO3 | MgO | |
| H2O | Tan -> Tạo thành dung dịch | Tan -> Tạo thành dung dịch | Không tan |
| Qùy tím | Hóa xanh | Hóa đỏ | Đã nhận biết |
PTHH: Na2O + H2O ->2 NaOH
SO3 + H2O -> H2SO4
Bài 2: Chọn B
| Nước cất | dd NaCl | dd H2SO4 | dd NaOH | |
| Qùy tím | Tím | Tím | Đỏ | Xanh |
| Đun cạn | Không hiện tượng | Có tinh thể tráng mịn | Đã nhận biết | Đã nhận biết |
Bài 3: Chọn B.
Loại A vì A có CO2, NO2 là oxit axit. Loại C vì C có NO2, P2O5 là oxit axit. Loại D vì D có SO3, CO2 là oxit axit.
Câu 1: D
MgO ko tan trong nước
SO3 tan trong nước tạo ra dung dịch axit H2SO4 lm quỳ tìm chuyển màu đỏ.
Na2O tan trong nước tạo ra dung dịch bazơ NaOH lm quỳ tìm chuyển màu xanh.
Câu 2: B
Dùng quỳ tím => Phân biệt được H2SO4 và NaOH ( giống như trên)
Đun cạn nước cất => ko có gì
Đun cạn dung dịch NaCl => Có các tinh thể muối
Bài 3: B
Vì oxit bazo là oxit của kim loại

a, Nhúng quỳ tím vào 2 lọ dd
- Nếu quỳ tím chuyển xanh \(\rightarrow\) nhận biết đc KOH
- Nếu quỳ tím chuyển đỏ → nhận biết đc HCl
b, Hòa tan 3 chất rắn vào nước -> nhận biết đc MgO không tan
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(K_2O+H_2O\rightarrow2KOH\)
Nhúng quỳ tím vào 2 lọ dd
+ Quỳ tím chuyển đỏ-> nhận biết đc đó là \(H_3PO_4\)-> Chất ban đầu là \(P_2O_5\)
+ Quỳ tím chuyển xanh -> nhận biết đc dd KOH -> chất bạn đầu là \(K_2O\)

\(2KClO_3--to->2KCl+3O_2\)
\(S+O_2-to->SO_2\)
\(2SO_2+O_2--to\left(V_2O_5\right)->2SO_3\)
\(2Mg+O_2--to->2MgO\)
\(4Al+3O_2-->2Al_2O_3\)
PTHH :
\(2Mg+O_2\rightarrow2MgO\)
\(4Al+3O_2\rightarrow2Al_2O_3\)
\(2Al+3PbO\rightarrow Al_2O_3+3Pb\)
\(S+O_2\rightarrow SO_2\)
\(2SO_2+O_2\rightarrow2SO_3\)
\(\left(NH_4\right)_2SO_4+2HCl\rightarrow SO_2+H_2O+2NH_2Cl\)

- Trích một ít các chất làm mẫu thử
- Hòa tán các chất vào nước có pha vài giọt quỳ tím:
+ Chất rắn tan, dd chuyển xanh: CaO, Na2O
CaO + H2O --> Ca(OH)2
Na2O + H2O --> 2NaOH
=> Thu được 2 dd Ca(OH)2, NaOH (1)
+ Chất rắn tan, dd chuyển màu đỏ:P2O5
P2O5 + 3H2O --> 2H3PO4
+ Chất rắn tan, dd không chuyển màu: NaCl
+ Chất rắn không tan: MgO
- Dẫn khí CO2 vào lượng dư dd ở (1):
+ Xuất hiện kết tủa trắng: Ca(OH)2 => Nhận biết được CaO
Ca(OH)2 + CO2 --> CaCO3 + H2O
+ Không hiện tượng: NaOH => Nhận biết được Na2O
2NaOH + CO2 --> Na2CO3 + H2O

+ Trích 4 chất trên thành 4 mẫu thử nhỏ, đánh số
+ Cho H2O lần lượt vào 4 mẫu thử, quan sát:
. . . . . Mẫu thử nào không có hiện tượng gì là SiO2. Ta nhận ra được SiO2
. . . . . Ba mẫu thử còn lại tan ra là BaO, P2O5 và Na2O
BaO+H2O−−−>Ba(OH)
P2O5+3H2O−−−>2H3PO4
Na2O+H2O−−−>2NaOH
+ Cho quỳ tím lần lượt vào 3 dung dịch thu được ở trên, quan sát:
. . . . . Mẫu thử nào làm quỳ tím hóa đỏ là H3PO4, vậy chất ban đầu là P2O5. Ta nhận ra được P2O5
. . . . . Hai mẫu thử còn lại làm quỳ tím hóa xanh là Ba(OH)2 và NaOH=> Chất ban đầu là BaO và Na2O.
+ Cho axit sunfuric H2SO4 lần lượt vào hai mẫu thử còn lại:
. . . . . Mẫu thử nào thấy xuất hiện kết tủa trắng và tỏa nhiều nhiệt là BaSO4 => Chất ban đầu là BaO. Ta nhận ra được BaO
BaO+H2SO4−−−>BaSO4+H2O
BaO+H2SO4−−−>BaSO4+H2O
. . . . . Mẫu thử còn lại là Na2ONa2O
Vậy ta đã nhận ra được các chất trên
Đúng tick nha chúc bạn học tốt
. Trích mẫu thử và đánh số thứ tự.
. Cho nước vào các mẫu thử trên.
+ Mẫu thử không tan là \(SiO_2\)
+ Mẫu thử tan tạo thành dung dịch là BaO, \(P_2O_5\), \(Na_2O\)
PTHH:
\(BaO+H_2O->Ba\left(OH\right)_2\)
\(P_2O_5+3H_2O->2H_3PO_4\)
\(Na_2O+H_2O->2NaOH\)
+ Ta nhúng mẩu giấy quỳ tím vào 3 dung dịch trên.
. Dung dịch làm cho giấy quỳ tím hóa đỏ => đó là \(H_3PO_4\) (chất rắn ban đầu là \(P_2O_5\) ). Vậy ta nhận biết được \(P_2O_5\)
. Dung dịch mà làm quỳ tím hóa xanh => đó là NaOH (chất ban đầu là \(Na_2O\)) và \(Ba\left(OH\right)_2\) (chất ban đầu là BaO)
+ Cho 2 mẫu thử BaO và \(Na_2O\) vào dung dịch \(H_2SO_4\) loãng.
. Mẫu thử nào tan, tạo kết tủa trắng => đó là \(BaSO_4\) (chất ban đầu là BaO)
PTHH: \(BaO+H_2SO_4->BaSO_4\downarrow+H_2O\)
. Mẫu thử không tạo kết tủa trắng => đó là \(Na_2O\)
PTHH: \(Na_2O+H_2SO_4->Na_2\left(SO_4\right)+H_2O\)

-Trích các mẫu chất rắn vào óng ngiệm khác nhau.
-Cho nước vào ống ngiệm:
+Tan trong nước là P2O5, Na2O
+Không tan trong nước là Al2O3, CuO
P2O5+3H2O\(\rightarrow\)2H3PO4
Na2O+H2O\(\rightarrow\)2NaOH
-Cho quỳ tím vào H3PO4 và NaHO
+Quỳ tím chuyển xanh là Na2O (là NaOH)
+quỳ tím chuyển đỏ là P2O5 (là H3PO4)
-Cho Cuo và Al2O3 vào dung dịch hCl
+Có kết tủa màu trắng là Al2O3 ( kết tủa là AlCl3)
+Không có kết tủa là CuO
| CuO | + | 2HCl | → | 2H2O | + | CuCl2 |
| (rắn) | (dung dịch) | (lỏng) | (dung dịch) | |||
| (xanh lá) | (không màu) | (không màu) | (xanh lam) |
| Al2O3 | + | 6HCl | → | 2AlCl3 | + | 3H2O |
| (rắn) | (dung dịch) | (kết tủa) | (lỏng) | |||
| (trắng) | (không màu) |
- Cho CuO và Al2O3 vào dung dịch H2SO4
+Có dung dịch màu xanh là CuO (dung dịch là CuSO4)
+Không có dung dịch màu xanh là Al2O3
| CuO | + | H2SO4 | → | H2O | + | CuSO4 |
| (rắn) | (dung dịch) | (lỏng) | (dung dịch) | |||
| (đen) | (không màu) | (không màu) | (xanh lam) |
| Al2O3 | + | 3H2SO4 | → | Al2(SO4)3 | + | 3H2O |
| (rắn) | (dung dịch) | (rắn) | (lỏng) | |||
| (trắng) | (không màu) | (trắng) | (không màu) |

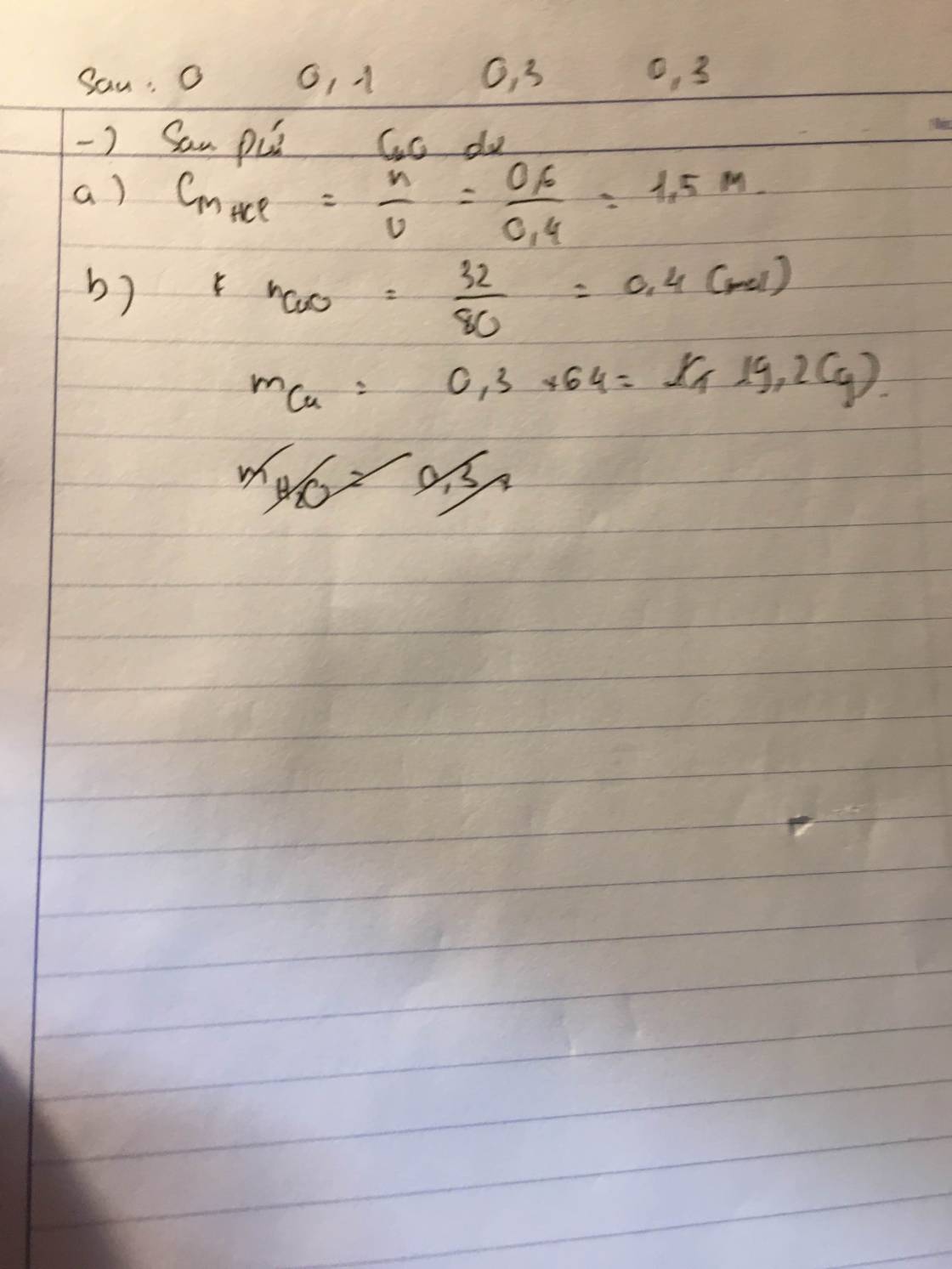
a) - Lấy mẫu thử và đánh dấu
- Cho quỳ tím vào các mẫu thử
+ Mẫu thử làm quỳ tím hoá xanh chất ban đầu là KOH
+ Mẫu thử không làm quỳ tím chuyển màu chất ban đầu là NaCl
+ Mẫu thử làm quỳ tím hoá đỏ chất ban đầu là HCl và H2SO4 (1)
- Cho Ba(OH)2 vào nhóm 1
+ Mẫu thử xuất hiện kết tủa trắng chất ban đầu là H2SO4
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
+ Mẫu thử không hiện tượng chất ban đầu là HCl
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
b) - Lấy mẫu thử và đánh dấu
- Cho nước vào các mẫu thử
+ Mẫu thử có khí bay lên chất ban đầu là Na
2Na + 2H2O → 2NaOH + H2
+ Mẫu thử tan trong nước chất ban đầu là Na2O
Na2O + H2O → 2NaOH
+ Mẫu thử không tan trong nước chất ban đầu là Al2O3 và MgO (1)
- Cho NaOH vào nhóm 1
+ Mẫu thử tan trong NaOH chất ban đầu là Al2O3
2NaOH + Al2O3 → 2NaAlO2 + H2O
+ Mẫu thử không tan trong NaOH chất ban đầu là MgO
a) - Trích mỗi chất một ít làm mẫu thử
- Cho quỳ tím lần lượt vào các mẫu thử
+ Mẫu làm quỳ tím chuyển sang màu xanh: KOH
+ Mẫu làm quỳ tím chuyển sang màu đỏ: HCl, H2SO4
+ Mẫu không làm đổi màu quỳ tím: NaCl
- Cho dd BaCl2 vào các mẫu làm quỳ tím chuyển sang màu đỏ
+ Mẫu xuất hiện kết tủa: H2SO4
........BaCl2 + H2SO4 --> BaSO4 (kết tủa) + 2HCl
+ Mẫu còn lại (ko pứ): HCl
b) - Trích mỗi chất một ít làm mẫu thử
- Cho nước lần lượt vào các mẫu thử
+ Mẫu xuất hiện khí: Na
.......2Na + 2H2O --> 2NaOH + H2
+ Mẫu tạo thành dung dịch không có khí: Na2O
...........Na2O + H2O --> 2NaOH
+ Mẫu ko pứ: Al2O3, Mg
- Cho NaOH các các mẫu thử còn lại
+ Mẫu tác dụng với NaOH: Al2O3
.............Al2O3 + 2NaOH --> 2NaAlO2 (tan) + H2O
+ Mẫu còn lại (ko pứ): Mg