Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,S_{NaCl\left(25^oC\right)}=\dfrac{36}{100}.100=36\left(g\right)\\ C\%=\dfrac{36}{100+36}.100\%=26,47\%\\ b,S_{đường}=\dfrac{20}{10}.100+200\left(g\right)\\ C\%_{đường}=\dfrac{200}{200+100}.100\%=66,67\%\)

a) mdd =15+65=80g
b)
⇒SNa2CO3=\(\dfrac{53}{250}\).100=21,2g
Vậy độ tan của muối Natricacbonat ở 18 độ C là 21,2g
a. mdd = 15+65 = 80 (g)
b. Độ tan của muối Na2CO3 ở 18^oC là : S = (53 x 100)/250 = 21,2 (gam).

bài 1: nZn= 0,5 mol
Zn + 2HCl → ZnCl2 + H2↑
0,5 mol 1 mol 0,5 mol 0,5 mol
a) mHCl= 36,5 (g) → mdung dịch HCl 10% = 36,5 / 10%= 365 (g)
b) mZnCl2= 0,5x 136= 68 (g)
c) mdung dịch= mZn + mdung dịch HCl 10% - mH2= 32,5 + 365 - 0,5x2 = 396,5 (g)
→ C%ZnCl2= 68/396,5 x100%= 17,15%
Bài 2: Cách phân biệt:
Dùng quỳ tím:→ lọ nào làm quỳ chuyển thành màu đỏ: HCl và H2SO4 (cặp I)
→ quỳ không đổi màu: BaCl2 và NaCl ( cặp II)
→ quỳ chuyển màu xanh: NaOH và Ba(OH)2 ( cặp III)
Đối với cặp I: ta cho dung dịch BaCl2 vào, ống có kết tủa trắng chính là ống đựng H2SO4, ống còn lại chứa dung dịch HCl
Đối với cặp II: ta cho dung dịch H2SO4 vào, ống có kết tủa trắng chính là ống đựng BaCl2, ống còn lại là NaCl
Đối với cặp III: ta cho dung dịch H2SO4 vào, ống có kết tủa trắng chính là ống đựng Ba(OH)2, ống còn lại là NaOH
PTPU: BaCl2 + H2SO4→ BaSO4↓ + 2HCl
Ba(OH)2 + H2SO4→ BaSO4↓ + 2H2O

a, _Đánh STT cho các lọ_
- Cho que đóm còn đang cháy vào từng lọ:
+ Cháy mãnh liệt hơn: O2
+ Cháy màu xanh nhạt: H2
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
+ Vụt tắt: CO2
b, \(C\%_{NaCl}=\dfrac{40}{40+120}.100\%=25\%\)
a.Đưa que đóm đỏ vào 3 lọ:
-O2: qua đóm cháy mãnh liệt
-H2: qua đóm cháy với ngọn lửa xanh, nổ nhẹ
-CO2: qua đóm vun tắt đi
b.\(m_{dd}=40+120=160g\)
\(C\%_{NaCl}=\dfrac{40}{160}.100\%=25\%\)

Độ tan của muối Na 2 CO 3 ở 18 º C là: S = (53 x 100)/250 = 21,2 (gam).

Ở 20 0 C thì 75g nước hòa tan tối đa muối NaCl có khối lượng:
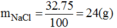
Vậy dung dịch NaCl đã pha chế là chưa bão hòa. Để dung dịch NaCl bão hòa ở nhiệt độ này, ta cần cho thêm vào dung dịch đã pha chế một lượng NaCl là: 24-23,5=0,5(g)

\(S_{Na_2CO_3}=\dfrac{53}{250}.100=21,2\)
\(C\%=\dfrac{53}{250+53}.100\%=17,5\%\)

Bài 1:
- Trích mỗi chất một ít làm mẫu thử
- Nhúng quỳ tím vào các mẫu thử:
+ Mẫu làm quỳ tím chuyển sang màu đỏ: HCl
+ Mẫu làm quỳ tím chuyển sang màu xanh: NaOH
+ Mẫu không làm đổi màu quỳ tím: NaCl
Bài 2:
b) Ta có: \(21,2=\dfrac{m}{250}.100\)
=> \(m=\dfrac{21,2\times250}{100}=53\left(g\right)\)
c) mdd = 53 + 250 = 303 (g)
C% dd Na2CO3 = \(\dfrac{53}{303}.100\%=17,5\%\)
P/s: câu a tự làm