Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Zn + S → ZnS
0,02 0,01 (mol)
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol.

Vì các kim loại không thay đổi hóa trị nên khối lượng muối của oxit phản ứng với HCl bằng khối lượng muối của kim loại phản ứng với Cl2 dư
Có nHCl=2\(n_{H_2}\)=0,1(mol)
=>mHCl=0,1.36,5=3,65(g)
\(m_{H_2O}\)=\(\dfrac{0,1}{2}.18=0.9\left(g\right)\)
Theo ĐLBTKL ta có
moxit+maxit=mmuối+mnước
=>mmuối=24,35(g)
Khối lượng muối clorua thu được khi cho X tác dụng với Cl2 dư hay oxit Y tác dụng với HCl là như nhau vì mX không đổi, hoá trị không đổi
PTHH: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
Ta có: \(n_{HCl}=0,1\cdot1=0,1\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}m_{HCl}=0,1\cdot36,5=3,65\left(g\right)\\n_{H_2O}=0,05\left(mol\right)\Rightarrow m_{H_2O}=0,05\cdot18=0,9\left(g\right)\end{matrix}\right.\)
Bảo toàn khối lượng: \(m_{muối}=m_{oxit}+m_{HCl}-m_{H_2O}=21,6+3,65-0,9=24,35\left(g\right)\)

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

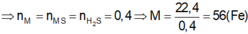





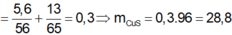




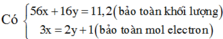
4Na+ O2-> 2Na2O
nO2= 2,24/22,4=0,1mol
nNa=4,6/23=0,2 mol
Tỉ lệ: 0,2/4< 0,1/1=> Na td hết, O2 dư
nNa2O= (0,2.2)/4=0,1 mol
m Na2O= 0,1.(23.2+16)=6,2g
Câu 1