

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C.
Zn + S → ZnS
0,02 0,01 (mol)
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol.

nB=0,2 mol
M(B) = 9,4.2=18,8
Áp dụng sơ đồ đường chéo
CO2 (44) 18,8-2=16,8
18,8
H2 (2) 44-18,8=25,2
nCO2 : nH2 = 16,8:25,2 = 2:3
=> nCO2 = 2/5 .0,2=0,08 mol
nH2=3/5 .0,2= 0,12 mol
Zn + H2SO4 = ZnSO4 + H2
0,12....0,12......................0,12
MgCO3 + H2SO4 = MgSO4 + H2O + CO2
0,08...........0,08...................................0,08
=> m=0,12.65+0,08.84=14,52 g
nH2SO4 =0,2 mol
=> mH2SO4=19,6g
=> m ddH2SO4 = 19,6:12%=163,33333 g

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Trong phản ứng hóa học , phản ứng nào có sự chuyển dịch electron điều liên quan đến "điện hóa". Khi này phản ứng nào có chênh lệch thế điện hóa (ΔE)càng lớn càng dễ dàng phán ứng, tức ưu tiên xảy ra trước.
Vậy thì trong hệ có bao nhiêu cặp có thể sinh ra chênh lệch thế điện hóa cứ liệt kê ra. Ở mỗi cặp phải có một tác nhân cho electron và một tác nhân nhận electron thì mới tạo thành một phản ứng điện hóa. Trường hợp này có 3 cặp :
Cặp 1 : Fe3+ + 1 e --> Fe2+ Eo = 0.771
...........Zn - 2e --> Zn2+ Eo = -0.763
=> ΔE = 0.771 - (-0.763) = 1.534
Cặp 2 : Fe2+ + 2 e --> Fe Eo = -0.44
............Zn - 2e ---> Zn2+ Eo = -0.763
=> ΔE = -0.44 - (-0.763) = 0.296
Cặp 3 : 2H+ + 2 e ---> H2 Eo = 0
............ Zn - 2 e --> Zn2+ Eo = -0.763
=> ΔE = 0 - (-0.763) = 0.763
Xếp từ lớn tới bé : Cặp 1 > Cặp 3 > Cặp 2
Vậy cặp 1 xảy ra trước nhất, khi không còn tác nhân đảm bảo cho cặp 1 , đến cặp 3, tương tự cho đến cặp 2 . Nghĩa là Zn phản ứng với Fe3+ để tạo thành Fe2+, sau đó hết Fe3+ mà vẫn còn kẻm thì Zn tác dụng với H+ tạo thành H2 , khi hết H+ mà vẫn còn Zn, Zn tác dụng với Fe2+ tạo thành Fe. Bạn đã nghĩ đúng.
~~~~~~~~~~~~~~~~~~~
Bài giải trên chỉ đúng trong trường hợp tất cả các tác nhân điều có nồng độ 1 mol/l
Nếu nồng độ các tác nhân khác nhau , lúc này phải tích chênh lệch thế điện hóa cân bằng, ký hiệu Ecb. Với Ecb được tính bằng công thức :
Ecb = Eo + 0.059/n . log ([Ox]/[Kh])
trong đó n là cái số trong phương trình này: Kh - n e --> Ox
[Ox] - nồng độ tác nhân Oxi hóa
[Kh] - nồng độ tác nhân khử
Theo công thức trên khi [Ox] = [Kh] = 1 mol/l thì log([Ox]/[Kh]) = log(1) = 0 vậy Ecb = Eo

số mol kẽm phản ứng: \(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,1 0,1 0,1 (mol)
a,Thể tích khí H2 thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,Thể tích dung dịch H2SO4 1M đã dùng:
\(V_{H_2SO_4}=\frac{n_{H_2SO_4}}{C_M}=\frac{0,1}{1}=0,1\left(l\right)=100\left(ml\right)\)

1.
\(Br_2+SO_2+2H_2O\rightarrow H_2SO_4+2HBr\)
Phần 1
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)
0,02_____________0,02___________
\(n_{BaSO_4}=\frac{4,66}{137+32+16.4}=0,02\left(mol\right)\)
Phần 2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
\(Ba\left(OH\right)_2+2HBr\rightarrow BaBr_2+2H_2O\)
Ta thấy chia 2 phần bằng nhau mà kết tủa(BaSO4) phần 2 nhiều hơn phần 1
\(\rightarrow\) Phần 2 có SO2 tác dụng với Ba(OH)2
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3+H_2O\)
___________0,03_____0,03____________
\(m_{BaSO3}=1,17-4,66=6,5\left(l\right)\)
\(n_{BaSO3}=\frac{6,51}{137+32+16.3}=0,03\left(mol\right)\)
Tổng nSO2=2.(0,02+0,03)=0,1 (Vì chia làm 2 phần bằng nhau nên khi tính mol ban đầu phải nhân 2 nha bạn)
\(CM_{SO2}=\frac{0,1}{0,2}=0,5M\)
\(n_{Br2}=0,02.2=0,04\)
\(C\%_{Br2}=\frac{0,04.160}{32}=20\%\)
2.
a)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
\(BaCO_3\rightarrow BaO+CO_2\)
\(MgCO_3\rightarrow MgO+CO_2\)
b)
\(n_{hh_{khi}}=\frac{2,464}{22,4}=0,11\left(mol\right)\)
\(n_{CO2}=\frac{3,584}{22,4}=0,16\left(mol\right)\)
Gọi a là số mol Al b là số mol BaCO3 c là số mol MgCO3 trong 0,2 mol
Ta có:
\(\left\{{}\begin{matrix}a+b+c=0,2\\b+c=0,16\end{matrix}\right.\rightarrow a=0,04\left(mol\right)\)
\(\%n_{Al}=\frac{0,04}{0,2}.100\%=20\%\)
Gọi x là số mol Al y là nBaCO3 z là nMgCO3 trong 10,65 g X
Ta có
\(27x+197y=84x=10,65\)
\(1,5x+y+z=0,11\)
\(x=0,2.\left(x+y=z\right)\)
\(\rightarrow x=0,02;y=0,03;z=0,05\)
\(\%m_{Al}=\frac{0,02.27}{10,65}.100\%=5,07\%\)
\(\%m_{BaCO3}=\frac{0,03.197}{10,65}.100\%=55,49\%\)
\(\%m_{MgCO3}=39,44\%\)
3.
\(H_2+Cl_2\rightarrow2HCl\left(1\right)\)
______0,03___ 0,06
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\left(2\right)\)
\(n_{AgCl}=\frac{0,17}{108+35,5}\)
\(n_{HCl\left(1\right)}=\frac{0,17}{108+35,5}.\frac{20}{5}=\frac{34}{7175}\)
\(n_{H2}=\frac{1}{22,4}\)
\(n_{Cl2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(H=\frac{34}{7175}/0,06.100\%=7,9\%\)

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!

Các phản ứng oxi hóa – khử là: a; b; c và d.
a)
* Fe2O3 + CO \(\underrightarrow{t^o}\) FeO + CO2
Bước 1:
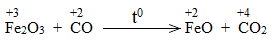
Bước 2:
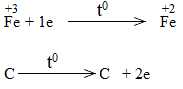
Bước 3:
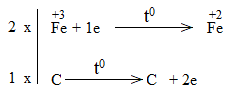
Bước 4:
Fe2O3 + CO \(\underrightarrow{t^o}\) 2FeO + CO2
Fe2O3 là chất oxi hóa.
CO là chất khử.
* FeO + CO \(\underrightarrow{t^o}\) Fe + CO2
Bước 1:
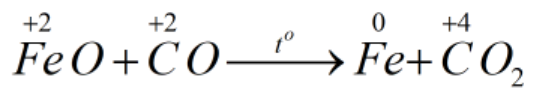
Bước 2:
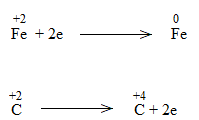
Bước 3:
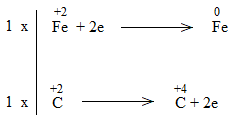
Bước 4:
FeO + CO \(\underrightarrow{t^o}\) Fe + CO2
FeO là chất oxi hóa.
CO là chất khử.
b)
* ZnS + O2 \(\underrightarrow{t^o}\) ZnO + SO2
Bước 1:
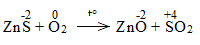
Bước 2:
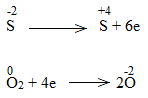
Bước 3:
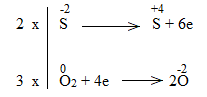
Bước 4:
2ZnS + 3O2 \(\underrightarrow{t^o}\) 2ZnO + 2SO2
* ZnO + C \(\underrightarrow{t^o}\) Zn + CO
Bước 1:
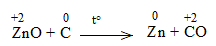
Bước 2:
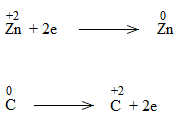
Bước 3:
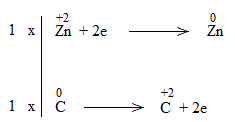
Bước 4:
ZnO + C to\(\underrightarrow{t^o}\) Zn + CO
ZnS là chất khử.
O2 là chất oxi hóa
c)
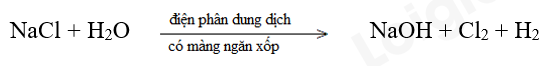
Bước 1:
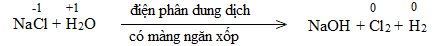
Bước 2:
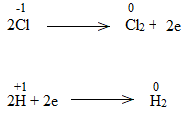
Bước 3:
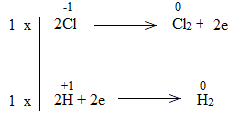
Bước 4:

NaCl là chất khử.
H2O là chất oxi hóa.
d) C2H5OH + O2 \(\underrightarrow{t^o}\) CO2 + H2O
Bước 1:
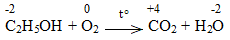
Bước 2:
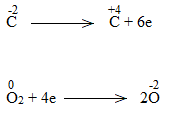
Bước 3:
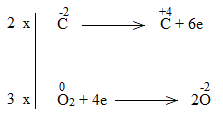
Bước 4:
C2H5OH + 9/2O2 \(\underrightarrow{t^o}\) 2CO2 + 6H2O
C2H5OH là chất khử.
O2 là chất oxi hóa.