Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl= nHCl . MHCl
= 0,4 . 36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
b) Số mol của muối sắt (II) clorua
nFeCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,2 . 127
= 25,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 200 - ( 0,2 .2)
= 210,8 (g)
c) Nồng độ phần trăm của muối sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{25,4.100}{210,8}=12,05\)0/0
d) Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.300}{100}=21,9\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,6 0,3 0,3
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe
Sau phản ứng thu được muối FeCl2 và dung dịch HCl còn dư
Số mol của sắt (II) clorua
nFeCl2 = \(\dfrac{0,6.1}{2}=0,3\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2 = nFeCl2 . MFeCl2
= 0,3 . 127
= 38,1 (g)
Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,6 - (0,2 . 2)
= 0,2 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư. MHCl
= 0,2 . 36,5
= 7,3 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 300 - (0,3 . 2)
= 310,6 (g)
Nồng độ phần trăm của sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{38,1.100}{310,6}=12,27\)0/0
Nồng độ phần trăm của dung dịch axit clohdric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{7,3.100}{310,6}=2,35\)0/0
Chúc bạn học tốt

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=n_{FeCl_2}=n_{H_2}=0,2\left(mol\right)\\n_{HCl}=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,2\cdot56=11,2\left(g\right)\\m_{FeCl_2}=0,2\cdot127=25,4\left(g\right)\\m_{ddHCl}=\dfrac{0,4\cdot36,5}{10\%}=146\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddHCl}-m_{H_2}=156,8\left(g\right)\) \(\Rightarrow C\%_{FeCl_2}=\dfrac{25,4}{156,8}\cdot100\%\approx16,2\%\)

PTHH: \(K_2SO_3+2HCl\rightarrow2KCl+H_2O+SO_2\uparrow\)
a+b+c) Ta có: \(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{KCl}=0,5\left(mol\right)=n_{HCl}\\n_{K_2SO_3}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{K_2SO_3}=0,25\cdot158=39,5\left(g\right)=a\\m_{KCl}=0,5\cdot74,5=37,25\left(g\right)\\m_{ddHCl}=\dfrac{0,5\cdot36,5}{10,95\%}\approx166,67\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{SO_2}=0,25\cdot64=16\left(g\right)\)
\(\Rightarrow m_{dd}=m_{K_2SO_3}+m_{ddHCl}-m_{SO_2}=190,17\left(g\right)\) \(\Rightarrow C\%_{KCl}=\dfrac{37,25}{190,17}\cdot100\%\approx19,59\%\)
d) PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Theo PTHH: \(n_{NaOH}=n_{HCl}=0,5\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,5}{0,5}=1\left(l\right)\)

a.250ml=0,25l ; nHCl=0,25.1,5=0,375mol
KOH+HCl->KCl+H2O
1mol 1mol 1mol
0,375 0,375 0,375
VKOh=0,375/2=0,1875l
b.CM KCL=0,375/0,25=1,5M
c.NaOH+HCL=NaCl+H2O
1mol 1mol
0,375 0,375
mdd NaOH=0,375.40.100/10=150g

200ml = 0,2l
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,3 0,6 0,3 0,3
a) \(n_{ZnCl2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(C_{M_{ZnCl2}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\)
b) \(n_{H2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
c) Pt : \(NaOH+HCl\rightarrow NaCl+H_2O|\)
1 1 1 1
0,6 0,6
\(n_{NaOH}=\dfrac{0,6.1}{1}=0,6\left(mol\right)\)
\(m_{NaOH}=0,6.40=24\left(g\right)\)
\(m_{ddNaOH}=\dfrac{24.100}{20}=120\left(g\right)\)
Chúc bạn học tốt

\(2Al+3H_2SO_4 \to Al_2(SO_4)_3+3H_2\\ n_{Al}=0,4(mol)\\ a/\\ n_{H_2}=\frac{3}{2}.0,4=0,6(mol)\\ V_{H_2}=0,6.22,4=13,44(l)\\ b/\\ n_{H_2SO_4}=n_{H_2}=0,6(mol)\\ n_{ddH_2SO_4}=\frac{0,6.98.100}{20}=294(g)\\ c/\\ n_{Al_2(SO_4)_3}=0,2(mol)\\ C\%_{Al_2(SO_4)_3}=\frac{0,2.342}{10,8+294-0,6.2}.100\%=22,52\%\)
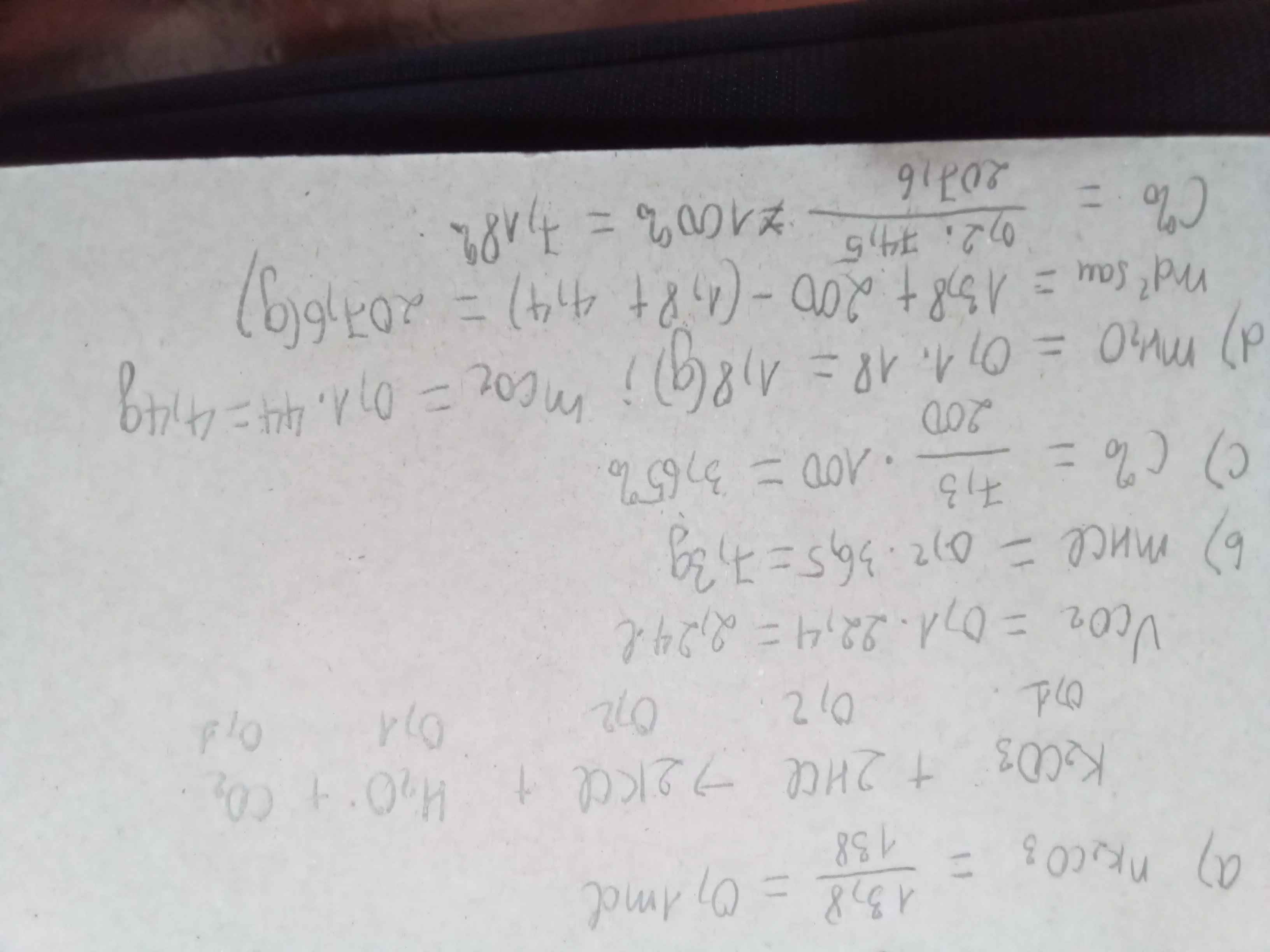
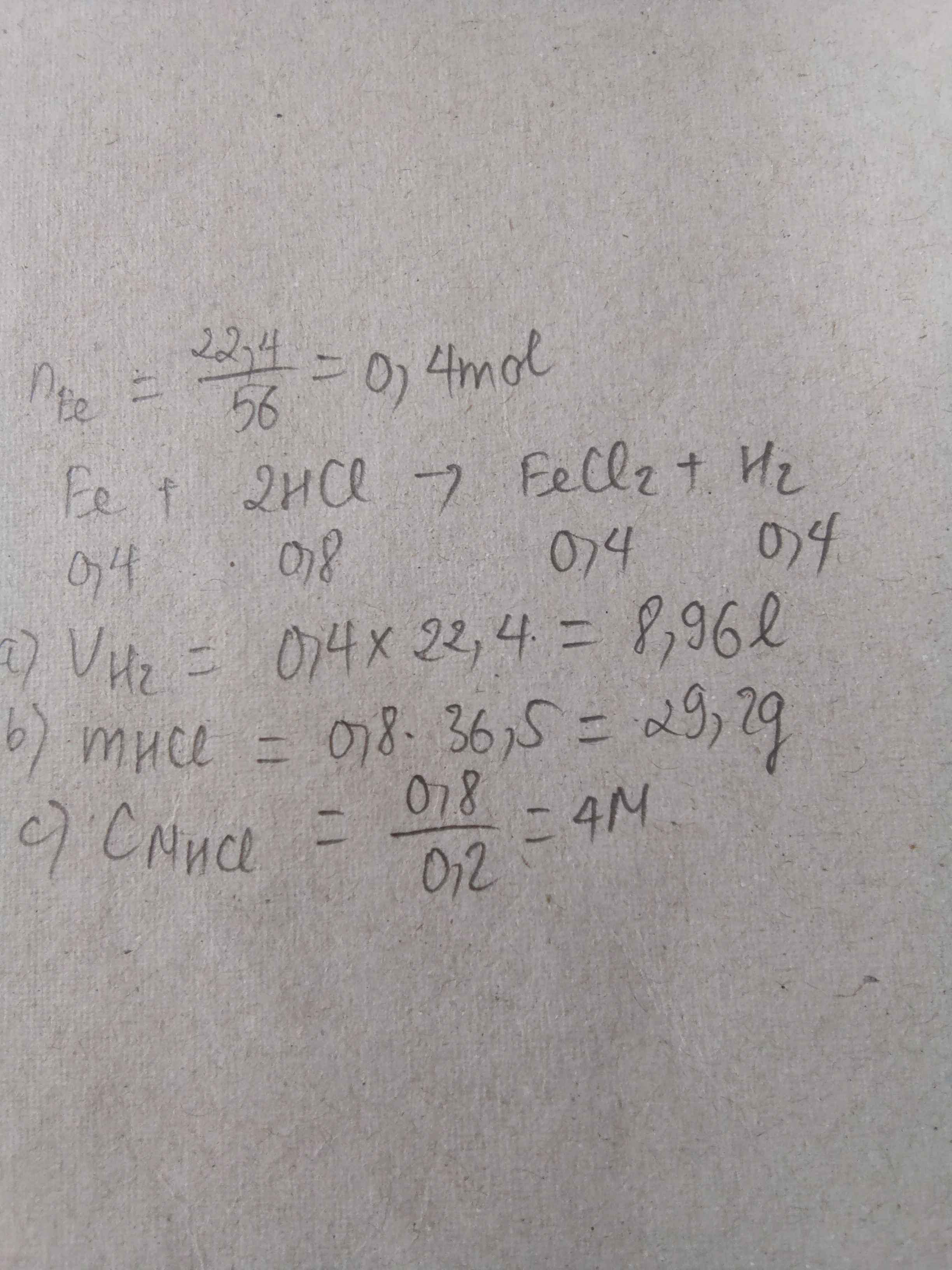
ủa bạn ơi câu d và e đâu ạ