Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\) (1)
\(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\) (2)
b) Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\\Sigma n_{H_2SO_4}=0,2\cdot1=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{Zn}=n_{ZnO}=n_{H_2SO_4\left(1\right)}=n_{H_2SO_4\left(2\right)}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=0,1\cdot65=6,5\left(g\right)\\m_{ZnO}=0,1\cdot81=8,1\left(g\right)\end{matrix}\right.\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{Zn}=n_{ZnSO_4\left(1\right)}=0,1mol\\n_{ZnO}=n_{ZnSO_4\left(2\right)}=0,1mol\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{ZnSO_4}=0,2mol\) \(\Rightarrow C_{M_{ZnSO_4}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
(Coi như thể tích dd thay đổi không đáng kể)

a/ \(n_{CO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\)
\(0,5---0,5----0,5---0,5-0,5\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(b---b----b-----b\)
\(\Rightarrow m_{MgCO_3}=0,5.\left(24+12+16.3\right)=42\left(g\right)\)
\(\dfrac{m_{MgCO_3}}{m_{MgO}}=\dfrac{7}{3}\Rightarrow m_{MgO}=42.\dfrac{3}{7}=18\left(g\right)\Rightarrow n_{MgO}=b=0,45\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4}=0,45+0,5=0,95\left(mol\right)\) \(\Rightarrow m_{dd}=\dfrac{0,95.98}{0,05}=1862\left(g\right)\)

1> Mg+2HCl------>MgCl2+H2
Zn+2HCl----->ZnCl2+H2
mHCl=250.7,3/100=18,25 g
nHCl=18,25/36,50,5 mol
Giả sử 4,93 g hỗn hợp toàn là kim loại Mg
n tối đa =4,93/24=0,205 mol--->nHCl tối đa=0,205.2=0,41 mol
giả sử 4,93 g hỗn hợp toàn là Zn
n tối thiểu =4,93/65=0,076 mol----->nHCl tối thiểu=0,076.2=0,152 mol-
----->0,152<nHCltham gia phản ứng<0,41
mà nHcl=0,5 mol----->HCl dư-----> hỗn hợp tan hết

\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O|\)
1 6 2 3
0,2 1,2 0,4
\(n_{Fe}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m_{Fe2O3}=27,2-11,2=16\left(g\right)\)
0/0Fe = \(\dfrac{11,2.100}{27,2}=41,18\)0/0
0/0Fe2O3 = \(\dfrac{16.100}{27,2}=58,82\)0/0
b) Có : \(m_{Fe2O3}=16\left(g\right)\)
\(n_{Fe2O3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,4+1,2=1,6\left(mol\right)\)
\(V_{HCl}=\dfrac{1,6}{2}=0,8\left(l\right)\)
c) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(n_{FeCl3}=\dfrac{1,2.2}{6}=0,4\left(mol\right)\)
\(C_{M_{FeCl2}}=\dfrac{0,2}{0,8}=0,25\left(M\right)\)
\(C_{M_{FeCl3}}=\dfrac{0,4}{0,8}=0,5\left(M\right)\)
Chúc bạn học tốt

7840ml = 7,84l
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Pt : Zn + H2SO4 → ZnSO4+ H2\(|\)
1 1 1 1
0,35 0,35 0,35 0,35
ZnO + H2SO4 → ZnSO4 + H2O\(|\)
1 `1 1 1
a) Số mol của kẽm
nZn = \(\dfrac{0,35.1}{1}=0,35\left(mol\right)\)
Khối lượng của kẽm
mZn = nZn . MZn
= 0,35. 65
= 22,75 (g)
Khối lượng của kẽm oxit
mZnO = 25,95 - 22,75
= 3,2 (g)
0/0Zn = \(\dfrac{m_{ct}.100}{m_{hh}}=\dfrac{22,75.100}{15,95}=87,67\)0/0
0/0ZnO = \(\dfrac{m_{ct}.100}{m_{hh}}=\dfrac{3,2.100}{25,95}=12,33\)0/0
b) Số mol của muối kẽm sunfat
nZnSO4 = \(\dfrac{0,35.1}{1}=0,35\left(mol\right)\)
Khối lượng của muối kẽm sunfat
mZnSO4= nZnSO4 . MZnSO4
= 0,35 . 161
= 56,35 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = (mZn + mZnO) + mH2SO4 - mH2
= 25,95 + 20 - (0,35 . 2)
= 45,25 (g)
Nồng độ phần trăm của muối kẽm sunfat
C0/0ZnCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{56,35.100}{45,25}=124,53\)0/0
c) Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,35.1}{1}=0,35\left(mol\right)\)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,35 . 98
= 34,3 (g)
Nồng độ phần trăm của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{34,3.100}{20}=171,5\)0/0
Chúc bạn học tốt

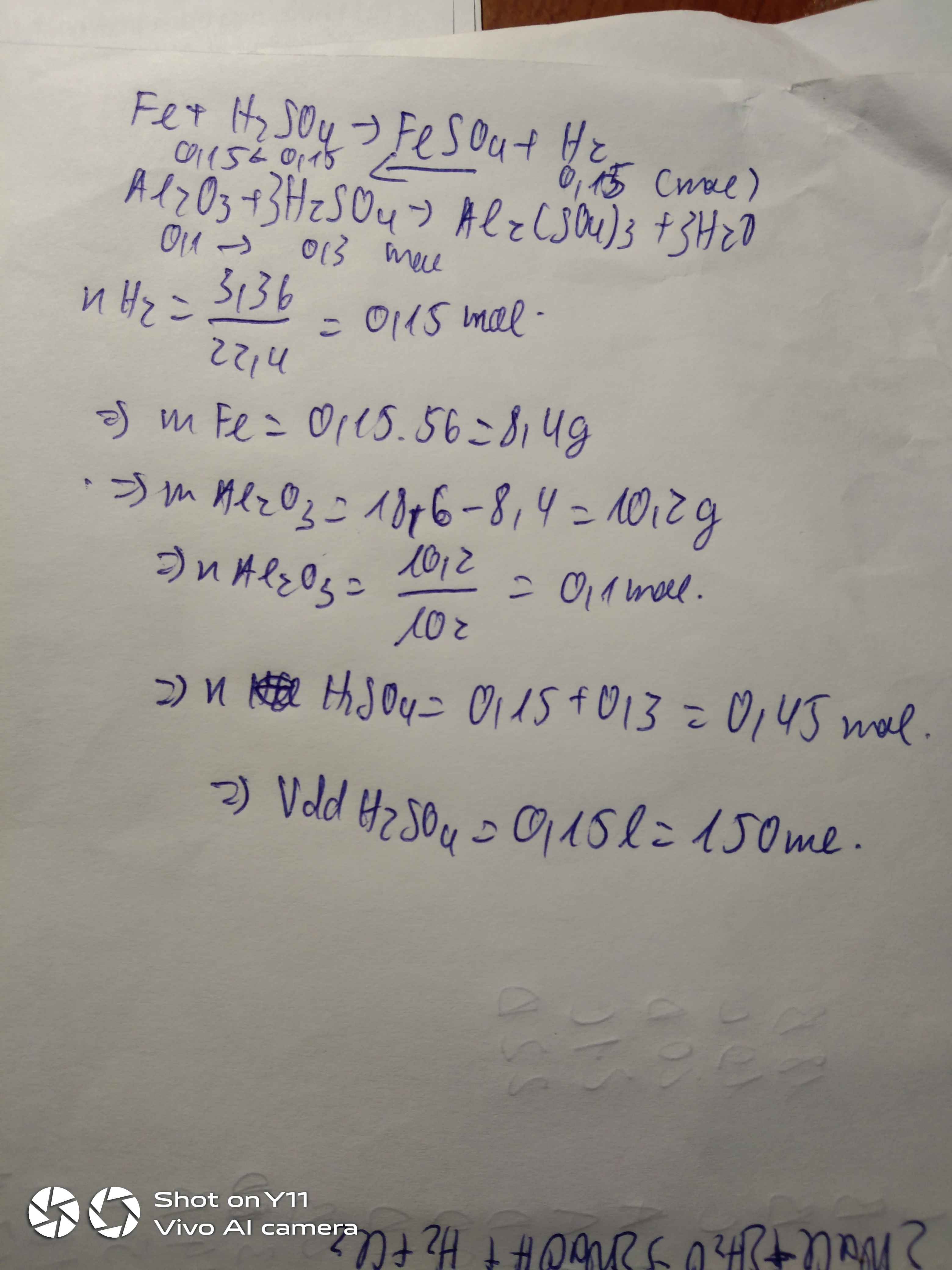
\(n_{hhA}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Zn + H2SO4 → ZnSO4 + H2↓ (1)
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O (2)
Khí A: H2, CO2
a) Gọi x,y lần lượt là số mol của Zn và MgCO3
Ta có: \(\left\{{}\begin{matrix}65x+84y=20,05\\x+y=0,25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,2\end{matrix}\right.\)
Vậy \(n_{Zn}=0,05\left(mol\right)\Rightarrow m_{Zn}=0,05\times65=3,25\left(g\right)\)
\(n_{MgCO_3}=0,2\left(mol\right)\Rightarrow m_{MgCO_3}=0,2\times84=16,8\left(g\right)\)
\(\%m_{Zn}=\frac{3,25}{20,05}\times100\%=16,21\%\)
\(\%m_{MgCO_3}=100\%-16,21\%=83,79\%\)
b) \(n_{H_2SO_4}=0,6\times0,5=0,3\left(mol\right)\)
Theo PT1,2: \(\Sigma n_{H_2SO_4}pư=\Sigma n_{hhA}=0,25\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4}dư=0,3-0,25=0,05\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}dư=\frac{0,05}{0,6}=0,083\left(M\right)\)
Theo PT1: \(n_{ZnSO_4}=n_{Zn}=0,05\left(mol\right)\)
\(\Rightarrow C_{M_{ZnSO_4}}=\frac{0,05}{0,6}=0,083\left(M\right)\)
Theo PT2: \(n_{MgSO_4}=n_{MgCO_3}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{MgSO_4}}=\frac{0,2}{0,6}=0,333\left(M\right)\)
c)Theo Pt1: \(n_{H_2}=n_{Zn}=0,05\left(mol\right)\)
\(\Rightarrow m_{H_2}=0,05\times2=0,1\left(g\right)\)
Theo pT2: \(n_{CO_2}=n_{MgCO_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{CO_2}=0,2\times44=8,8\left(g\right)\)
\(m_{hhA}=m_{H_2}+m_{CO_2}=0,1+8,8=8,9\left(g\right)\)
\(\Rightarrow M_{hhA}=\frac{8,9}{0,25}=35,6\left(g\right)\)
\(\Rightarrow d_{\frac{A}{H_2}}=\frac{M_A}{M_{H_2}}=\frac{35,6}{2}=17,8\)