Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) a(g) vào cốc CaCO3 xảy ra phản ứng:
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
b(g) vào cốc Cu xảy ra phản ứng:
\(Cu+H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
- Ở cốc 1 khối lượng tăng lên là (56/100)a. Ở cốc b khối lượng không thay đổi nên không thể xác định tỉ lệ a/b
b) \(CaCO_3+H_2SO_4\rightarrow CaSO_4+CO_2+2H_2O\)Cu vào cốc 1 không phản ứng.
Ở cốc 2, khối lượng tăng lên là: (56/100)a(g), cốc 2 tăng lên b(g)
Để cân thăng bằng thì (56/1000a=b=>a/b=100/56

a) Lúc đầu: C12H22O11 + H2SO4 → 12C(đen) + H2SO4.11H2O
Sau đó: C12H22O11 + 24H2SO4 → 12CO2↑ + 24SO2↑ + 35H2O
Khi nhỏ axit H2SO4 đặc vào saccarozo, ta thấy đường nhanh chóng hóa đen, sau đó khối rắn tăng thể tích rất nhanh và thoát khí mùi hắc (SO2). Quan sát phương trình ta thấy chỉ 1 mol đường nhưng tạo ra những (12 + 24 = 35) mol khí, vì vậy thể tích khối rắn tăng lên nhanh.
b) 3H2SO4 + 2Fe(OH)3 ⟶ Fe2(SO4)3 + 6H2O
Hiện tượng : Chất rắn màu nâu đỏ Sắt III hidroxit (Fe(OH)3) tan dần trong dung dịch H2SO4, tạo ra dung dịch màu vàng nâu
c) CuO + 2HCl ⟶ 2H2O + CuCl2
Hiện tượng : Chất rắn màu đen đồng II oxit (CuO) tan dần trong dd, tạo thành dd màu xanh lam là CuCl2.
d)Cu + 2H2SO4 ⟶ 2H2O + SO2 + CuSO4
Hiện tượng: Chất rắn màu đỏ Đồng (Cu) tan dần trong dung dịch và sủi bọt khí do khí mùi hắc Lưu huỳnh dioxit (SO2) sinh ra.

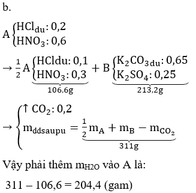
a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|

\(n_{Fe}=\frac{a}{56}\left(mol\right);n_{Al}=\frac{b}{27}\left(mol\right)\)
\(PT:Fe+2HCl\rightarrow FeCl_2+H_2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\left(2\right)\)
\(n_{H_2\left(1\right)}=n_{Fe}=\frac{a}{56}\left(mol\right)\)
\(n_{H_2\left(2\right)}=\frac{3}{2}n_{Al}=\frac{b}{18}\left(mol\right)\)
Vì 2 cốc đựng dung dịch HCl và dung dịch H2SO4 ở vị trí thăng bằng, mà cho a gam Fe vào cốc đựng dung dịch HCl, cho b gam Al vào cốc đựng dung dịch H2SO4, cân vẫn ở vị trí thăng bằng nên \(m_{Fe}-m_{H_2\left(1\right)}=m_{Al}-m_{H_2\left(2\right)}\)
\(\Leftrightarrow a-\frac{a}{56}.2=b-\frac{b}{18}.2\)
\(\Leftrightarrow a-\frac{a}{28}=b-\frac{b}{9}\)
\(\Leftrightarrow\frac{27}{28}a=\frac{8}{9}b\)
\(\Rightarrow\frac{a}{b}=\frac{\frac{8}{9}}{\frac{27}{28}}=\frac{224}{243}\)

PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)=n_{H_2}\) \(\Rightarrow m_{H_2}=0,05\cdot2=0,1\left(g\right)\)
\(\Rightarrow\) Cốc B nhẹ hơn cốc A là 0,1 gam

nCaCO3 = 20/100 = 0.2 (mol)
CaCO3 + 2HCl => CaCl2 + CO2 + H2O (1)
0.2_____________________0.2
2Al + 3H2SO4 => Al2(SO4)3 + 3H2 (2)
a_________________________1.5a
Vì cân bằng nên :
m bình (1) tăng = m bình (2) tăng
=> mCaCO3 - mCO2 = mAl - mH2
=> 20 - 0.2*44 = 27a - 1.5a*2
=> a = 7/15
mAl = 7/15 * 27= 12.6 (g)
Câu 1:
Gọi a là số mol của H2SO4 có trong dung dich H2SO4
\(=>mH_2SO_4=98a(g)\)
\(=>nH_2O=49a(mol)\)
\(=>mH_2O=49a.18=882a(g)\)
\(=>mddH_2SO_4=882a+98a=980a(g)\)
Nồng đọ phần trăm của dung dich H2SO4 trên là:
\(C\%H_2SO_4=\dfrac{98a.100}{980a}=10\%\)