Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(2Fe+6H_2SO_4\text{đặc}\rightarrow^{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_4\text{đặc}\rightarrow^{t^0}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_4\text{đặc}\rightarrow3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
Quy đổi hỗn hợp A gồm x mol Fe và y mol O
\(\Rightarrow56x+16y=49,6\) (1)
\(Fe\rightarrow Fe^{3+}+3e\)
x ------------> 3x
\(S^{+6}+2e\rightarrow S^{+4}\)
..........0,8 <--- 0,4
\(O+2e\rightarrow O^{2-}\)
y --> 2y
\(\Rightarrow3x=2y+0,8\) (2)
Giải hệ (1)(2) được x = 0,7 mol, y = 0,65 mol
\(\Rightarrow\%m_O=\dfrac{16.0,65}{49,6}.100\%=20,97\%\)
Ta có:
\(2H_2SO_4+2e\rightarrow SO_4^{2-}+SO_2\uparrow+2H_2O\)
...............................0,4 <---- 0,4
\(\Rightarrow n_{SO_4^{2-}}\text{tạo muối với cation kim loại}=0,4\) mol
\(\Rightarrow m_{\text{muối}}=m_{\text{kim loại}}+m_{SO_4^{2-}}\text{tạo muối với cation kim loại}\)
\(=56.0,7+96.0,4=77,6\) gam

a) n Fe = a(mol) ; n Cu = b(mol)
=> 56a + 64b = 4,8(1)
n SO2 = 2,24/22,4 = 0,1(mol)
Bảo toàn e :
3n Fe + 2n Cu = 2n SO2
<=> 3a + 2b = 0,2(2)
Từ (1)(2) suy ra a = b = 0,04
%m Fe = 0,04.56/4,8 .100% = 46,67%
%m Cu = 100% -46,67% = 53,33%
b)
n KOH = 0,15
Ta có :
1 < n KOH / n SO2 = 0,15/0,1 = 1,5 < 2 nên muối sinh ra là Na2SO3(x mol) và NaHSO3(y mol)
2NaOH + SO2 $\to$ Na2SO3 + H2O
NaOH + SO2 $\to$ NaHSO3
Theo PTHH :
n SO2 = a + b = 0,1
n NaOH = 2a + b = 0,15
Suy ra a= 0,05 ; b = 0,05
m muối = 0,05.126 + 0,05.104 = 11,5 gam
Bài 2 :
- Gọi số mol Fe và Cu lần lượt là a, b mol
Ta có : mhh = mFe + mCu = 56a + 64b = 4,8
Bte : 3a + 2b = 0,2
=> a = b =0,04mol
a, Ta có : mFe =n.M = 2,24g ( 46,7% )
=> %Cu = 53,3%
b, Ta thấy sau phản ứng thu được K+, SO3-2 xmol, HSO3- y mol
BtS : x + y = 0,1
BTĐT : 2x + y = 0,15
=> x =y = 0,05 mol
=> mM = mK2SO3 + mKHSO3 = 13,9g

a, Ta có: 24nMg + 56nFe = 9,2 (g) (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BT e, có: 2nMg + 2nFe = 2nH2 = 0,5 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,15\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,15.24}{9,2}.100\%\approx39,13\%\\\%m_{Fe}\approx60,87\%\end{matrix}\right.\)
b, BTNT H, có: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)

Phần 1:
Fe + 2HCl → FeCl2 + H2
nH2 = 4,48:22,4 = 0,2 mol = nFe
<=> mFe = 0,2.56 = 11,2 gam
=> mCu = 35,2:2 - 11,2 = 0,1 mol
Phần 2:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
=> nSO2 = 0,3 + 0,1 = 0,4 mol <=> V = 0,4.22,4 = 8,96 lít
=>nH2SO4 phản ứng = 3.0,2 + 2.0,1 = 0,8 mol
=> nH2SO4 ban đầu = 0,8 + 0,8.15% = 0,92 mol
<=>m dung dịch = m(Fe + Cu) + mH2SO4 - mSO2 = 35,2:2 + 0,92.98 - 0,4.64 = 82,16 gam
C%Fe2(SO4)3 = \(\dfrac{0,1.400}{82,16}.100\%\)= 48,7%
C%CuSO4 = \(\dfrac{0,1.160}{82,16}.100\%\) = 19,5%
C%H2SO4 dư = \(\dfrac{0,8.15\%.98}{82,16}\).100% = 14,7%

\(n_{HCl} = \dfrac{448.1,12.3,65\%}{36,5} = 0,50176(mol)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ ZnO + 2HCl \to ZnCl_2 + H_2O\\ n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ n_{ZnO} = \dfrac{n_{HCl} - 2n_{Zn}}{2} = \dfrac{0,50176-0,1.2}{2} = 0,15088(mol)\\ \%m_{Zn} = \dfrac{0,1.65}{0,1.65 + 0,15088.81}.100\% = 34,72\%\\ \%m_{ZnO} = 65,28\%\)


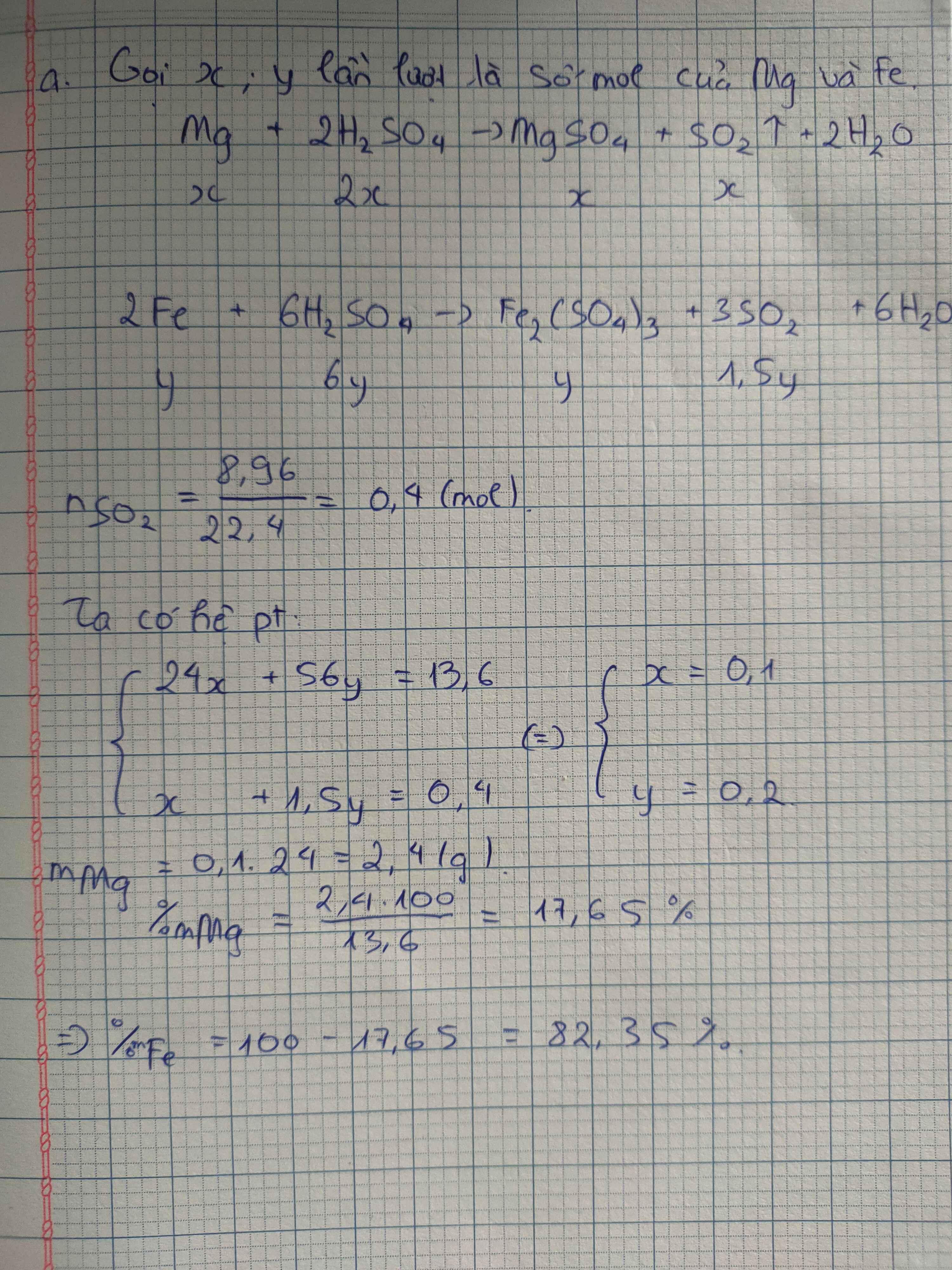


1, Tau phải bt Fe2O3 tác dụng vs dd H2SO4 đặc nóng thì sản phẩm khí thu được vẫn là H2 và ko có khí SO2.
do đó nFe=2/3 nSO2=0,02 (bạn biết pt ra rồi cân bằng là hiểu);
a,%Fe=0,02*56/2,72=41,18%;
%Fe2O3= 58,82%;
b, do nNaOH/nSO2= 10/3 >2 nên sản phẩm chỉ gồm muối trung hòa và NaOH dư;
ta có nNa2CO3 =nSO2= 0,03(mol);
CM(Na2CO3)= 0,03/0,2 =0,15(M);
CM(NaOH dư)=(0,1-0,06)/0,2=0,2 (M);
c; trích mấu thử đánh dấu :
dùng BaCl2 nhận ra NaCl vì không còn hiện tg còn lại xuất hiện kết tủa trắng.
2 chất còn lại thì dùng dd HCl nhận ra Na2SO3 vì sủi bọt khí Na2SO4 ko có hiện tg gì